微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,将100 mL的0.02 mol·L-1的Ba(OH)2溶液和100 mL的0.02 mol·L-1的NaHSO4溶液混合,若忽略溶液体积变化,则混合后的溶液
A.pH=2
B.pH=12
C.由水电离产生的c(H+)=1.0×10-2mol·L-1
D.溶质的物质的量浓度为0.02mol·L-1
参考答案:B
本题解析:
试题分析:Ba(OH)2和 NaHSO41:1反应,方程式为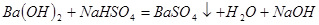 ;根据方程式,生成氢氧化钠的物质的量为0.002mol,浓度为0.01 mol·L-1,故B正确。
;根据方程式,生成氢氧化钠的物质的量为0.002mol,浓度为0.01 mol·L-1,故B正确。
考点:本题考查根据方程式的计算。
本题难度:一般
2、选择题 下列电离方程式中,正确的是( )
A.CH3COOH=CH3COO-+H+
B.NaOH=Na++OH-
C.KClO3?K++ClO3-
D.NaHCO3=Na++H++CO32-
参考答案:B
本题解析:
本题难度:简单
3、选择题 能促进水的电离,并使溶液中的c(H+)<c(OH-)的操作是
A.向水中投入一小块金属钠
B.向水中加入NaOH固体
C.向水中加入NaCl固体
D.向水中加入NH4Cl固体
参考答案:A
本题解析:
本题难度:困难
4、填空题 (12分)某溶液可能含有K+、Mg2+、Al3+、Cl2、SO42-、S2-、NO3-中的几种,为确定溶液中的微粒种类,进行如下实验:
①通过观察,发现溶液呈浅黄绿色;
②取少许原溶液,滴加NaOH溶液直至过量,发现先有沉淀生成,后沉淀减少但并不完全消失;
③取少许原溶液,滴加BaCl2溶液,无白色沉淀生成。
请根据上述信息回答下列问题:
(1)原溶液中肯定存在上述微粒中的________________,肯定不存在的微粒有_______________。
(2)不能确定是否存在上述微粒中的______________________,确定其是否存在的实验方法是____________________(不要求写具体操作过程)。
(3)若步骤②中得到沉淀的最大质量为9.7g,最终剩余沉淀质量为5.8g,据此步骤可确定原溶液中一定存在的微粒的物质的量之比为____________________。
(4)下列离子还可以在原溶液中大量共存的是___________(填字母)。
A.OH-
B.Fe2+
C.NH4+
D.CO32-
参考答案:(1)Mg2+、Al3+、Cl2、NO3- SO
本题解析:
试题分析:溶液呈黄绿色,说明溶液中含有Cl2,则原溶液中不存在S2-;取少许原溶液,滴加NaOH溶液直至过量,发现先有沉淀生成,后沉淀减少但并不完全消失,说明原溶液中存在Mg2+、Al3+,氢氧化铝沉淀溶于氢氧化钠溶液;取少许原溶液,滴加BaCl2溶液,无白色沉淀生成,说明不含SO42-,则原溶液中的阴离子只能是硝酸根离子。
(1)原溶液中一定存在的是Mg2+、Al3+、Cl2、NO3-;一定不存在的是SO42-、S2-;
(2)不能确定的离子是K+,钾离子的确定可通过焰色反应来判断;
(3)剩余沉淀为氢氧化镁沉淀,质量是5.8g,所以镁离子的物质的量是5.8g/58g/mol=0.1mol,则氢氧化铝沉淀的质量是9.7g-5.8g=3.9g,则铝离子的物质的量是3.9g/78g/mol=0.05mol,所以原溶液中n(Mg2+):n(Al3+)="2:1" ;
(4)A、氢氧根离子与镁离子、铝离子反应生成沉淀,不能大量共存,错误;B、亚铁离子与氯气反应生成铁离子和氯离子,不能大量共存,错误;C、铵根离子与溶液中存在的离子都不反应,可以大量共存,正确;D、碳酸根离子与镁离子生成碳酸镁沉淀,与铝离子发生水解反应生成沉淀和二氧化碳气体,不能大量共存,答案选C。
考点:考查溶液中离子的检验,离子大量共存的判断
本题难度:困难
5、选择题 313 K时,水的KW=3.0×10-14,则在313 K时,c(H+)=10-7 mol/L的溶液( )
A.呈酸性
B.呈中性
C.呈碱性
D.无法判断
参考答案:C
本题解析:解答本题时应注意以下两点:
(1)判断溶液的酸碱性最根本的依据是溶液中c(H+)与c(OH-)的相对大小;
(2)根据水在一定温度下的KW可以通过计算确定溶液呈中性时的c(H+)。
本题难度:一般