微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 用0.1320 mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号
| 待测NaOH溶液的体积/mL
| HCl溶液的体积/mL
|
1
| 25.00
| 24.41
|
2
| 25.00
| 24.39
|
3
| 25.00
| 22.60
回答下列问题:
(1)图中甲为 滴定管,乙为 滴定管(填“酸式”或“碱式 ”);
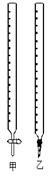
(2)取待测液NaOH溶液25.00 mL 于锥形瓶中,使用 做指示剂,滴定终点的判断依据是 ;
(3)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果 (填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果 ;
(4)该NaOH溶液的物质的量浓度为 mol/L (保留小数点后四位有效数字)。
参考答案:(1)酸式 碱式
本题解析:
试题分析:(1)酸式滴定管的开关是玻璃活塞,碱式滴定管的开关是橡胶管和玻璃珠。(2)标准酸滴定待测碱溶液选用酚酞或甲基橙指示剂均可以。酚酞 黄色变成橙色且半分钟内不恢复原有的颜色(或甲基橙 红色褪去且半分钟不再出现红色)
(3)若滴定前,滴定管尖端有气泡,滴定后气泡消失,则标准酸溶液的体积读数大,测得碱的浓度偏高;若读酸式滴定管读数时,滴定前仰视读数,读数偏大,滴定后正确读数,计算酸的体积=末读数-初读数,偏小,测得碱的浓度偏低;(4)c(碱)=c(酸)V(酸)/V(碱)=0.1320mol/L×24.40ml/25.00 mL="0.1288" mol/L
考点:酸碱中和滴定实验操作和误差分析
本题难度:一般
2、选择题 常温下用pH试纸测定某溶液的pH,如果将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,测得pH=6。则此溶液的实际pH
A.大于6
B.小于6
C.等于6
D.大于7
参考答案:B
本题解析:
试题分析:pH试纸使用时不能用蒸馏水润湿,若润湿,会导致溶液浓度降低,对酸性溶液来说,润湿后PH=6,说明原溶液的氢离子浓度大,则PH<6,选B。
考点:考查PH试纸的使用。
本题难度:一般
3、选择题 25 ℃时,在0.01 mol·L-1的硫酸溶液中,水电离出的H+浓度是 ( )
A.5×10-13 mol·L-1
B.0.02 mol·L-1
C.1×10-7 mol·L-1
D.1×10-12 mol·L-1
参考答案:A
本题解析:
试题分析:在该温度下水的离子积常数是1×10-14,c(H+)=0.02mol/L,所以c(OH-)=1×10-14mol2/L2 ÷0.02mol/L= 5×10-13 mol/L,而水电离产生的H+与OH-浓度相等,因此水电离出的H+浓度是5×10-13 mol/L,选项是A。
考点:考查水的离子积产生的应用的知识。
本题难度:一般
4、选择题 醋酸水溶液中的PH为2时,该溶液中C(OH—)是 ( )
A.1×10-7 mol·L-1
B.1×10-2mol·L-1
C.1×10-14 mol·L-1
D.1×10-12 mol·L-1
参考答案:D
本题解析:
正确答案:B
C(OH—)=Kw/ C(H+)=10
本题难度:简单
5、选择题 下列化学用语的表示中,不正确的是 [???? ]
A.NaHCO3电离方程式:NaHCO3 == Na+ + HCO3-
B.苯的实验式:CH
C.氢离子(H+)的结构示意图:
D.甲酸乙酯的结构简式:HC-O-OC2H5
参考答案:D
本题解析:
本题难度:简单
|