微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.水的电离方程式:H2O H++OH-
H++OH-
B.升高温度,水的电离程度增大
C.在NaOH溶液中没有H+,在HCl溶液中没有OH-
D.纯水中c(H+)=10-7 mol·L-1
参考答案:B
本题解析:
试题分析:水的电离是可逆反应,A错;水的电离是吸热反应,升高温度电离程度增大,B对;水会电离出H+、 OH-,所以NaOH溶液和HCl溶液中都有H+和OH-、C错;D中没有说明温度,错,选B。
考点:对水的电离的认识。
本题难度:一般
2、选择题 HA为酸性略强于醋酸的一元弱酸,则下列叙述正确的是
A.0. 1 mol?L-1 HA中c(H+)= c(OH-)+ c(A-)
B.0. 1 mol?L-1 HA与 0. 1 mol?L-1NaOH 混合至溶液呈中性:c(Na+)= c(A-)
C.0. 1 mol?L-1 NaA 中c(Na+)> c(OH-)>c(A-)> c(H+)
D.0. 1 mol?L-1 HA中加入少量NaA固体,HA的电离常数减小
参考答案:AB
本题解析:
试题分析:依题意,HA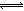 H++A—、H2O
H++A—、H2O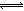 H++OH—,则稀HA溶液中含有A—、OH—、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+ c(OH-) = c(H+),故A选项正确;酸碱中和反应后所得溶液中含有A—、OH—、Na+、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+c(OH-)=c(Na+)+c(H+),若溶液呈电中性,则c(A-) =c(Na+),故B选项正确;NaA=Na++A—、H2O
H++OH—,则稀HA溶液中含有A—、OH—、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+ c(OH-) = c(H+),故A选项正确;酸碱中和反应后所得溶液中含有A—、OH—、Na+、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+c(OH-)=c(Na+)+c(H+),若溶液呈电中性,则c(A-) =c(Na+),故B选项正确;NaA=Na++A—、H2O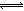 H++OH—,钠离子不能水解,少部分A—能水解生成HA,消耗水电离出的氢离子,促进水的电离,则稀盐溶液中c(Na+)>c(A-)>c(OH-)>c(H+),故C选项错误;稀HA溶液中存在电离平衡:HA
H++OH—,钠离子不能水解,少部分A—能水解生成HA,消耗水电离出的氢离子,促进水的电离,则稀盐溶液中c(Na+)>c(A-)>c(OH-)>c(H+),故C选项错误;稀HA溶液中存在电离平衡:HA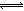 H++A—,NaA是强电解质,加入NaA固体,其完全电离出的A—增大溶液中c(A-),增大生成物浓度使弱酸电离平衡向逆反应方向移动,但HA的电离平衡常数只与温度有关,温度不变电离平衡常数不变,故D选项错误。
H++A—,NaA是强电解质,加入NaA固体,其完全电离出的A—增大溶液中c(A-),增大生成物浓度使弱酸电离平衡向逆反应方向移动,但HA的电离平衡常数只与温度有关,温度不变电离平衡常数不变,故D选项错误。
考点:考查水溶液中粒子浓度大小关系,涉及弱酸溶液或弱酸与强碱混合溶液中的电荷守恒关系式、酸性的酸碱性、盐溶液中离子浓度大小顺序、弱酸电离平衡的移动规律、弱酸电离平衡常数的影响因素及规律等。
本题难度:困难
3、选择题 下列说法正确的是 [???? ]
A.胶体与其他分散系的本质区别是能否发生丁达尔现象
B.一定温度下,任何酸、碱、盐的水溶液中,c(H+)·c(OH-)均为一定值
C.在可逆反应中,改变一个影响化学平衡的条件,其正、逆反应速率必然同时改变
D.船底镶嵌锌块,锌失电子,保护船体免受腐蚀
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列叙述正确的是
A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
B.常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小
C.在0.1 mol·L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+)
D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
参考答案:A
本题解析:
试题分析:A、HCl溶液中氢离子的物质的量小于氢氧化钡溶液中氢氧根离子的物质的量,所以溶液显碱性,则溶液中氢氧根离子的浓度=(10×2-10)mL×0.02mol/L/20mL=0.01mol/L,则氢离子的浓度是10-12mol/L,所以溶液的来源:91 考试网pH=12,正确;B、Ksp也是平衡常数,isUI温度变化而变化,但温度不变,溶度积不变,错误;C、醋酸钠溶液中,醋酸根离子水解生成醋酸和氢氧根离子,所以根据质子守恒,c(OH-)=c(CH3COOH)+c(H+),错误;D、常温下pH=4的NaHC2O4溶液为酸性溶液,则HC2O4-的电离程度大于其水解程度,电离产生C2O42-,水解产生H2C2O4,所以c(H2C2O4)<c(C2O42-),错误,答案选A。
考点:考查酸碱混合pH的计算,溶度积的判断,电解质溶液中离子浓度的判断
本题难度:一般
5、填空题 (7分)25℃,NaOH和Na2CO3两溶液的pH均为11.
(1)两溶液中,由水电离出得c(H2O)分别是①NaOH中 ,②Na2CO3中 ,③在1L水中加入上述 会使水的电离程度减小。
(2)各取10mL上述两种溶液,分别加水冲稀到100mL,pH变化较大的是 ,(填化学式)溶液。
(3)现有0.1mol/L的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是 ,你认为该溶液pH的范围一定介于 之间。
参考答案:(1)① 1×10—11mol/L &
本题解析:(1)根据水的电离方程式H2O H++OH-可知,氢氧化钠抑制水的电离,碳酸钠水解促进水的电离,所以由水电离出得c(H2O)分别是 1×10—11mol/、1×10—3mol/L。
H++OH-可知,氢氧化钠抑制水的电离,碳酸钠水解促进水的电离,所以由水电离出得c(H2O)分别是 1×10—11mol/、1×10—3mol/L。
(2)稀释会促进碳酸钠的水解,即OH-的物质的量是增加的,氢氧化钠在稀释过程中OH-的物质的量不变,所以pH变化较大的是氢氧化钠。
(3)碳酸钠水解显碱性,所以pH一定大于7。0.1mol/L的纯碱溶液中OH-的物质的量浓度一定小于0.1mol,所以该溶液pH的范围一定介于7~13之间。
本题难度:一般