微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (19分)运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;
(1)甲醇是重要的可再生燃料。已知在常温常压下:
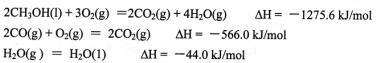
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_________。
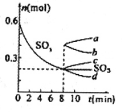
(2)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤.
①一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生上述反应,能说明该反应已达到平衡状态的是________。
a.体系的密度不发生变化
b.体系中硫元素的质量百分含量不再变化
c.SO2与SO3的体积比保持不变
d.容器内的气体分子总数不再变化
e.单位时问内转移4 mol电子,同时消耗2molSO3
②T℃时,在1L密闭容器中充入0.6 molSO3,下图表示SO3物质的量随时间的变化曲线。达到平衡时,用SO2表示的化学反应速率为________;SO3的转化率为________(保留小数点后-位):T℃时,反应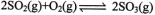 的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。
的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。
(3)有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。
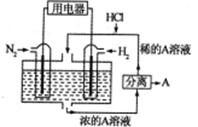
电池正极的电极反应式是_____电解质溶液的pH______(填写增大、减小、不变),A.物质是______(写化学式)。
2、填空题 (15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T(K)
| 938
| 1100
|
K
| 0.68
| 0.40
①写出该反应平衡常数的表达式__________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量_____;充入氦气,混合气体的密度____(选填“增大”、“减小”、“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
|