微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a
B.0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-) >c(OH-)
C.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液: c(HA)>C(Na+)>c(A-)
D.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:
3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
参考答案:C
本题解析:
试题分析:A.常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则pH=a,如为碱溶液,则pH=14-a,故A错误;B.0.1mol/L的KHA溶液,其pH=10,说明HA
本题难度:简单
2、选择题 硫化钠(Na2S)的水溶液中存在着多种微粒,下列关系正确的是
A.c(OH-)= c(HS-)+c(H+)+c(H2S)
B.c(OH-) = c(HS-)+c(H+)+2 c(H2S)
C.c(Na+) = c(S2-)+c(HS-) +c(H2S)
D.c(Na+)+c (H+)= c(HS-)+c(OH-)+c(S2-)
参考答案:B
本题解析:
试题分析:S2-的水解:S2-+H2O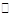 HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O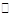 H2S+OH-,物料守恒:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),质子守恒:c(OH-)=c(HS-)+2c(H2S)+c(H+),因此B正确。
H2S+OH-,物料守恒:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),质子守恒:c(OH-)=c(HS-)+2c(H2S)+c(H+),因此B正确。
考点:考查物料守恒、电荷守恒、质子守恒。
本题难度:一般
3、填空题 (13分)高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:

根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10—38,除杂后溶液中c(Fe3+)约为 。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
(5)“分离”操作的名称是 (填字母代号)。
A.蒸馏 B.分液 C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是 ,离子浓度最小的离子是 。
参考答案:(13分) (1) 2Fe2++H2O2+4NH3·H2O=
本题解析:
试题分析:(1)H2O2可以把Fe2+氧化为Fe3+,然后加入氨水,就会形成Fe(OH)3沉淀而过滤除去,反应的离子方程式是2Fe2++H2O2+4NH3·H2O=2Fe(OH)3↓+4NH4+;(2)pH=8.0,则c(OH—)=10-6mol/L,在通常条件下Ksp〔Fe(OH)3〕=c(Fe3+)·c3(OH—)=4.0×10—38,所以c(Fe3+)= Ksp〔Fe(OH)3〕÷c3(OH—)= 4.0×10—38÷10-18=4×10—20mol/L;(3)硫酸铝是强酸弱碱盐,水解产生氢氧化铝胶体和硫酸,加入硫酸就可以抑制盐电离产生的Al3+的水解;(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干是因为蒸干容易使晶体失去结晶水,这样还避免可溶性杂质结晶析出;(5)把晶体从混合物中“分离”操作的名称是过滤;(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L在铵明矾的水溶液中,根据物料守恒可知离子浓度最大的离子是SO42—,由于该盐是强酸弱碱盐,NH4+、Al3+水解消耗水电离产生的OH-,使溶液显酸性,所以离子浓度最小的离子是OH—。
考点:考查物质制取的知识,包括反应条件的选择、离子方程式的书写、溶度积常数的应用、盐的水解、离子浓度的大小比较的知识。
本题难度:困难
4、选择题 下列说法错误的是
A.常温下,若醋酸钠与醋酸的混合溶液pH=7,则C(Na+)=c(CH3COO-)
B.某温度下,pH=6的NaCl溶液中离子浓度的大小关系:c(Na+)= c(Cl-)>c(H+)>c(OH-)
C.若2a mol·L-1HCN与a mol·L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则混合溶液pH>7
D.含0.1 mol NaHCO3和0.2molNa2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)
参考答案:B
本题解析:
试题解析:溶液中一定满足c(Na+)+c(H+)=c(CH3COO-)+c(OH-),pH=7,说明溶液中氢离子与氢氧根离子浓度相等,所以c(Na+)=c(CH3COO-),故A正确;NaCl溶液 一定呈中性,c(H+)=c(OH-),故B错误;2a mol·L-1HCN与a mol·L-1 NaOH溶液等体积混合,得等浓度的HCN和NaCN溶液,若溶液中c(Na+)>c(CN-),则HCN的电离程度小于CN-的水解程度,混合溶液pH>7,故C正确;含0.1 mol NaHCO3和0.2molNa2CO3的混合液中,根据电荷守恒知:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—),故D正确。
考点:离子浓度的关系
本题难度:困难
5、选择题 下列盐的水溶液,其pH值小于7的是( )
A.NH4Cl溶液
B.NaCl溶液
C.Na2SO4溶液
D.NaHCO3溶液
参考答案:A
本题解析:
试题解析:NH4Cl为强酸弱碱盐,其溶液呈酸性,pH值小于7,故A正确;NaCl溶液 、Na2SO4溶液为强酸强碱盐,溶液显中性,其pH值等于7,故B、C错误;NaHCO3中碳酸氢根离子水解程度大于电离程度,所以其溶液呈碱性,其pH值大于7,故D错误。
考点:盐类水解
本题难度:简单