微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 ?(m-x)CeO2
?(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2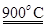 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是???????????,该反应将太阳能转化为?????????。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为???????????????。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= ???????。
HCO3-+OH-的平衡常熟Kh= ???????。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。

①电解过程中发生反应的离子方程式是????????????,阴极附近溶液PH??????(填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的????????。
a.Ba(OH)2 ???b.Ba(NO3)2??? c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式???????。
③图中氢氧化钠溶液的质量分数a%?b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为????????????????。
2、选择题 将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g) + Y(g) 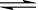 ?2Z(g);△H < 0。当改变某一条件并达到新平衡后,下列叙述正确的是
?2Z(g);△H < 0。当改变某一条件并达到新平衡后,下列叙述正确的是
A.缩小容器体积,Z的浓度不变
B.升高温度,X的转化率增大
C.保持容器体积不变,充入一定量的氦气,Y的浓度不变
D.保持压强不变,再充入0.2 mol X和0.2 mol Y,X的体积分数增大
3、选择题 在一定温度下,可逆反应X(g)+3Y(g)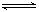 2Z(g)达到平衡的标志是???????
2Z(g)达到平衡的标志是???????
A.Z生成的速率与X生成的速率相等
B.单位时间生成a mol X,同时生成3a mol Y
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数比为1∶3∶2
4、填空题 (1)把a、b、c、d 四块金属片浸入稀H2SO4中,分别用导线两两相连可以组成原电池。a、b相连时,导线上电子由 a→b;c、d相连时,电流由 d→c; a、 c相连时 c极上产生大量气泡; b、 d相连时,d极发生氧化反应。这4种金属的活动性由强到弱的顺序是_______________
(2)王同学想在钥匙上镀上一层铜,设计电解实验时,钥匙应和电源的???极相连。
(3)碳作阳极,铜作阴极电解MgCl2溶液的离子方程式:??????????????????????????
碳作阴极,铜作阳极电解硫酸钠溶液的化学方程式:??????????????????????????????
(4)用惰性电极电解饱和食盐水,当电源供给0.2mol电子时,停止通电。若此时溶液体积为2L,则所得电解液的pH是??????。(不考虑气体的溶解)
(5)将含有0.4mol Cu(NO3)2和0.4mol KCl的溶液1 L,用铂电极电解一段时间后,在一个极析出0.3mol红色物质,则另一个极上放出气体(标准状况下)为??????L。
5、计算题 在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应:3A(g)+B(g) 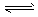 2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
(1)2min内B的反应速率为_________________
(2)此温度下该反应的平衡常数K=_________________________
(3)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量浓度_____________,C的质量分数___________,容器内气体的平均密度________________,平均相对分子质量________________。(填“增大”、“减小”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的物质的量与原平衡相等,则还应加入__________物质___________mol。