微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应①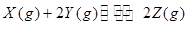 、②
、②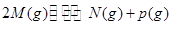 分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
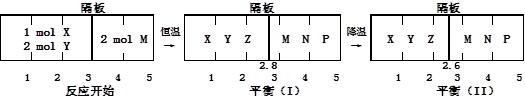
下列判断正确的是:
A.反应①的正反应是吸热反应
B.在平衡(I)和平衡(II)中的气体摩尔体积相同
C.达平衡(I)时X的体积分数为5/11
D.达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11
参考答案:D
本题解析:
试题分析:反应过程中①气体物质的量减少,②气体物质的量不变。A、平衡(I)降温至平衡(II),左室气体物质的量减少,平衡正向进行,反应放热,错误;B、平衡(I)和平衡(II)右室物质的量相同,体积不同,故气体摩尔体积不同,错误;
C、根据阿伏伽德罗定律,同温同压下气体体积比等于物质的量比,得出反应后左室物质的量为28/11mol,??? X+2Y?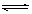 2Z?
2Z?
始量???1????? 2
转化量? a????? 2a??????? 2a
平衡量 1-a???? 2-2a?????? 2a
1-a+2-2a+2a=28/11??? a=5/11
平衡(I)时X的体积分数为6/11÷28/11=3/14,错误;
D、同温同压下气体压强比等于物质的量比,达平衡(I)时体系的压强与反应开始时体系的压强之比为(3+2):(2+28/11)=10:11,正确。
本题难度:一般
2、选择题 2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)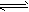 PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是 [???? ]
PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是 [???? ]
A.0.40mol
B.0.20mol
C.小于0.20mol
D.大于0.20mol,小于0.40mol
参考答案:C
本题解析:
本题难度:一般
3、选择题 在密闭容器中进行反应:X2(g)+Y2(g)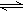 2Z(g)。已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L 、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是
2Z(g)。已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L 、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是
A.Z为0.3mol/L
B.Y2为0.35mol/L
C.X2为0.15mol/L
D.Z为0.4mol/L
参考答案:D
本题解析:由于反应是可逆反应,所以转化率不可能是100%的,如果Z的浓度变为0.4mol/L,则需要消耗0.1mol/L的X2,此时X2的浓度是0,所以是不可能的,答案选D。
本题难度:一般
4、选择题 已知H2(g)+I2(g) 2HI(g);△H<0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入0.1mol H2和0.2molI2,相同温度下分别达到平衡。下列说法不正确的是
2HI(g);△H<0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入0.1mol H2和0.2molI2,相同温度下分别达到平衡。下列说法不正确的是
A.乙中反应速率比甲中反应速率快
B.平衡时甲、乙两容器中混合物的总物质的量之比为2︰3
C.若平衡时甲中H2的转化率为40%,则乙中H2的转化率大于40%
D.平衡后,向乙中再加入0.1mol H2,建立新的平衡时,甲和乙中H2的百分含量不相同
参考答案:D
本题解析:本题考查化学平衡的影响因素及有关计算。乙中I2浓度比甲中大,反应更快,A正确;H2(g)+I2(g) 2HI(g)是等体积反应,平衡前后的物质的量不变,故平衡时甲、乙两容器中混合物的总物质的量之比为2︰3,B正确;乙中I2浓度比甲中大,故乙中H2的转化率大于40%,C正确;平衡后,向乙中再加入0.1mol H2,建立新的平衡与甲中平衡为等效平衡,甲和乙中H2的百分含量相同,D不正确。
2HI(g)是等体积反应,平衡前后的物质的量不变,故平衡时甲、乙两容器中混合物的总物质的量之比为2︰3,B正确;乙中I2浓度比甲中大,故乙中H2的转化率大于40%,C正确;平衡后,向乙中再加入0.1mol H2,建立新的平衡与甲中平衡为等效平衡,甲和乙中H2的百分含量相同,D不正确。
本题难度:一般
5、选择题 如果mg氨气由x个原子构成,则在2mg硫化氢中含有的分子数为
A.0.25x
B.0.5x
C.2x
D.4x
参考答案:A
本题解析:
本题难度:一般