8.8
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:___________________________
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的比值= 。
参考答案:HCO3—+H2O  本题解析: 本题解析:
试题分析:甲:升高温度,HCO3—水解程度增大,产生更多的OH-,c(OH-)增大,溶液的碱性增强。水解的两种方程式为:HCO3—+H2O  H2CO3+OH-。乙:酸性:H2CO3>HCO3-。同浓度是酸,溶液的酸性越强,其盐水解的程度越小。因此Na2CO3的水解程度大于NaHCO3的水解程度。(1)A.Ba(OH)2+ Na2CO3=BaCO3↓+2NaOH;Ba(OH)2+NaHCO3= BaCO3↓+H2O+NaOH。都产生白色沉淀。错误。B、BaCl2+ Na2CO3=BaCO3↓+2NaCl。BaCl2与NaHCO3不能发生反应。现象不同,可以鉴别二者。正确。C、NaOH溶液与Na2CO3不发生反应,无现象。NaOH +NaHCO3= Na2CO3+H2O。反应但是无明显现象,不能鉴别二者。错误。D、加入澄清石灰水发生反应:Ca(OH)2+ Na2CO3=CaCO3↓+2NaOH;Ca(OH)2+NaHCO3= CaCO3↓+H2O+NaOH。都产生白色沉淀。错误。因此可以证明乙的观点是正确的。(2)升高温度,盐溶液的pH增大,降低温度,盐溶液的pH又减小,恢复至原来的pH值。这证明甲的观点是正确的。(3)常温下, PH=9的NaOH溶液,a=c(OH-)(水)=c(H+)=10-9mol/L。PH=9的Na2CO3溶液, c(H+)=10-9mol/L, b=c(OH-)(水)=Kw÷c(H+)=10-14÷10-9=10-5mol/L.a:b=10-9mol/L: 10-5mol/L=10-4. H2CO3+OH-。乙:酸性:H2CO3>HCO3-。同浓度是酸,溶液的酸性越强,其盐水解的程度越小。因此Na2CO3的水解程度大于NaHCO3的水解程度。(1)A.Ba(OH)2+ Na2CO3=BaCO3↓+2NaOH;Ba(OH)2+NaHCO3= BaCO3↓+H2O+NaOH。都产生白色沉淀。错误。B、BaCl2+ Na2CO3=BaCO3↓+2NaCl。BaCl2与NaHCO3不能发生反应。现象不同,可以鉴别二者。正确。C、NaOH溶液与Na2CO3不发生反应,无现象。NaOH +NaHCO3= Na2CO3+H2O。反应但是无明显现象,不能鉴别二者。错误。D、加入澄清石灰水发生反应:Ca(OH)2+ Na2CO3=CaCO3↓+2NaOH;Ca(OH)2+NaHCO3= CaCO3↓+H2O+NaOH。都产生白色沉淀。错误。因此可以证明乙的观点是正确的。(2)升高温度,盐溶液的pH增大,降低温度,盐溶液的pH又减小,恢复至原来的pH值。这证明甲的观点是正确的。(3)常温下, PH=9的NaOH溶液,a=c(OH-)(水)=c(H+)=10-9mol/L。PH=9的Na2CO3溶液, c(H+)=10-9mol/L, b=c(OH-)(水)=Kw÷c(H+)=10-14÷10-9=10-5mol/L.a:b=10-9mol/L: 10-5mol/L=10-4.
考点:考查升高温度NaHCO3的水解程度增大的原因、NaHCO3与Na2CO3的鉴定、等pH的碱与盐中水电离程度的比较的知识。
本题难度:困难
2、填空题 (1)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=________。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=________。
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=________。
参考答案:(1)1×10-13
(2)①1∶10;②1∶9
本题解析:
本题难度:一般
3、填空题 设水的电离平衡线如图所示。

(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的PH=7,则
Ba(OH)2溶液和盐酸的体积比为__________。
参考答案:(1)10-14;10-12
(2)2:9
本题解析:
本题难度:一般
4、选择题 某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH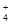 )之和 )之和
参考答案:A
本题解析:
试题分析:A.由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成的溶液,电离的CH3COOH与NaOH反应,仍可以继续电离使溶液呈酸性,且溶液中只有Na+、CH3COO-、H+、OH-四种离子;B.由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成,CH3COOH与NaOH恰好反应生成CH3COONa,溶液水解呈碱性;C.溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)不满足电荷守恒;D.加入大量的氨水,c(NH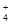 )>c(CH3COO-),不正确。 )>c(CH3COO-),不正确。
考点:溶液中的离子及其浓度。
本题难度:一般
5、选择题 下列说法正确的是( )
A.pH=7的溶液一定显中性
B.pH=6的溶液一定显酸性
C.c(H+)<c(OH-)的溶液一定显碱性
D.c(OH-)=1×10-6 mol/L的溶液一定显酸性
参考答案:C
本题解析:
试题分析:Kw≠10-14,pH=7的溶液不呈中性,Kw=10-12,pH=6的溶液显中性,所以A、B、D都错误,C正确。答案选C
考点:溶液酸碱性的判断
点评:用pH判断溶液的酸碱性时,要知道水的离子积,用c(H+)、c(OH-)相对大小来判断时,不需要任何条件。
本题难度:一般
|