微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 20.6gNH4HCO3和NaHSO3的干燥粉状混合物,用加热分解的实验方法来测定NH4HCO3的质量分数。已知:NaHSO3加热时会产生SO2。根据下图所示的仪器和所盛试剂填空:
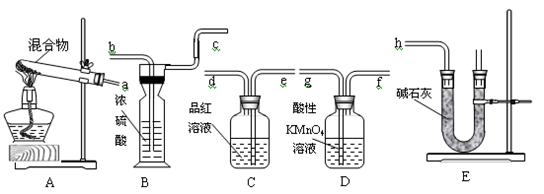
(1)按照气流由左→右的方向连接仪器的顺序(用a~h表示)为____________________。
(2)仪器B的名称为_________,E装置中放碱石灰的仪器名称为________,A和E装置中都用到的仪器名称为__________。
(3)D的作用是_______________________________________________________。
(4)C的作用是_________________________________;若C瓶中溶液颜色有变化,则测定结果可能会偏__________。
(5)B的作用是_____________________________________。
2、填空题 (15分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。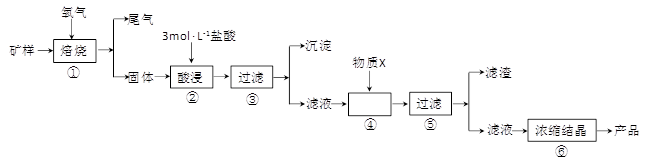
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
金属离子
| 氢氧化物开始沉淀的pH
| 氢氧化物沉淀完全的pH
|
Fe2+
| 7.0
| 9.0
|
Fe3+
| 1.9
| 3.2
|
Cu2+
| 4.7
| 6.7
|
回答下列问题:
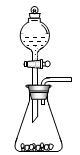
(l)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用上图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______________________、______________________。
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:____________________、__________________。
(3)步骤②酸浸过程中,需要用到3 mol · L-1的盐酸100 mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_______________________________________。
(4)步骤④加入物质X的目的是_________________________________________,物质X 可以选用下列物质中的______________________。
(A)氢氧化钠?(B)稀盐酸?(C)氨水?(D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol · L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=_____。
3、实验题 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
Ⅰ:在试管中加入3 mL 1 mol/L NaOH溶液和3 mL 溴乙烷,振荡,加热。
(1)设计实验证明上述实验中溴乙烷里的Br变成了Br-? (需说明:简单的实验操作及预测产生的实验现象)。
(2)观察到? 现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是? 和? 。
Ⅱ:在试管中加入3 mL NaOH乙醇溶液和3 mL 溴乙烷,振荡,加热。
(4)设计实验证明上述实验中溴乙烷发生的是消去反应? (需说明:简单的实验操作及预测产生的实验现象)。
4、填空题 在用稀盐酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的酸碱度变化如图所示。

(1)该反应的化学方程式____________________________.
(2)该实验操作是将_______________滴加到___________另一种溶液中。
(3)当加入溶液的质量为ag时,所得溶液中的溶质为______________(写化学式)。
(4)当加入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液呈_____________色。
5、简答题 工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的______吸收.
A.浓H2SO4 B. 氨水 C.NaOH溶液 ?D.稀HNO3
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,检验溶液中还存在Fe2+的方法是______(注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为______.
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是______.
a.粗铜接电源正极,发生氧化反应 ?b.溶液中Cu2+向阳极移动
c.利用阳极泥可回收Ag、Pt、Au等金属 ?d.电能全部转化为化学能
(5)利用反应2Cu+H2O2+H2SO4═CuSO4+2H2O可制得CuSO4,若将该反应设计为原电池,其正极电极反应式为______.