微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)KCIO3在农业上用作除草剂,超细CaCO3广泛用于生产牙膏、无炭复写纸等。某同学在实验室模拟工业生产,利用制乙炔产生的残渣制备上述两种物质,过程如下:
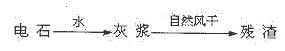
I.残渣中主要成分是Ca(OH)2和?。
II.将I中的部分灰浆配成浊液,通入Cl2在一定的温度下只得到Ca(ClO3)2与CaCl2两种溶质,该反应的化学方程式是?。
Ⅲ、向II所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得49.0克KClO3晶体,则理论上至少需要标准状况下Cl2?升。
Ⅳ、将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、CO2,便可获得超细CaCO3,过程如下:
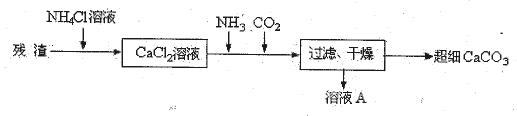
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因?。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是?。
③图示的溶液A可循环使用,其主要成分的化学式是?。
参考答案:(14分)
Ⅰ.CaCO3?(2分)
Ⅱ.6Cl2+6Ca(OH)2 = 5CaCl2+Ca(ClO3)2 + 6H2O?(3分)
Ⅲ.26.88或26.9?(2分)
Ⅳ.① CaCO3(s) Ca2++CO32-,NH4Cl溶液显酸性,使CO32-浓度减小,平衡向右移动,CaCO3溶解(或其他合理答案)?(2分)
Ca2++CO32-,NH4Cl溶液显酸性,使CO32-浓度减小,平衡向右移动,CaCO3溶解(或其他合理答案)?(2分)
② CaCl2 + 2NH3 + CO2 + H2O ="=" CaCO3↓+ 2NH4Cl?(3分)
③ NH4Cl?(2分)
本题解析:电石与水反应生成乙炔和灰浆:氢氧化钙,氢氧化钙在风干的过程中与二氧化碳反应生成碳酸钙;由6Cl2~ Ca(ClO3)2~2 KClO3
6x22.4? 2x122.5
V? 49? V=" 6x22.4" x49/245=26.88L
Ⅳ: ① CaCO3存在沉淀溶解平衡CaCO3(s) Ca2++CO32-,而NH4Cl溶液水解产生的H+
Ca2++CO32-,而NH4Cl溶液水解产生的H+
与CO32-反应使CO32-浓度减小,平衡向右移动,CaCO3溶解;②生成超细CaCO3与侯氏制碱法原理相同,生成的NH4Cl可循环使用。
本题难度:一般
2、实验题 化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
Ⅰ.制备
 K2C2O4
K2C2O4
FeCl3
⑴结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:_________________
_______________________________________________。
⑵操作Ⅲ的名称是___________。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应的化学方程式如下:
2 KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
⑶配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。两个滴定中,终点时溶液颜色为________色,且30 秒内不变色。
⑷该化合物KxFe(C2O4)y·3H2O中,x=_______。
参考答案:⑴用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解
⑵过滤、洗涤
⑶100mL容量瓶、酸式滴定管 (紫)红
⑷ 3
本题解析:本题涉及的制备是我们不熟悉的物质的制备,因此关于制备细节的考察,要么可以由我们以前的知识迁移而来,要么在题干中有所提示。
(1)故“冰水冷却”这句话很容易使我们想到是为了抑制溶解平衡,析出更多的晶体(这是知识的迁移);而“在黑暗处等待晶体析出”则和题干中的“光敏材料”对应,当推知黑暗是为了防止晶体见光分解。
(2)这是原有知识在新情境下的应用,考虑到前一步是结晶,结晶后自然要将晶体与母液分离、所以需要“过滤”, 如果再加上“洗涤”就更加严密。
(3)仍然是原有知识在具体新情境下的应用,题目中明确说道包含物质的量溶液配制和滴定实验,所以需要容量瓶和滴定管。关键是要准确写出“100mL容量瓶”,而KMnO4溶液有强氧化性,需用酸式滴定管盛放。关于终点颜色的判断,需要同学准确理解该滴定实验的原理,该实验是氧化还原滴定,终点时KMnO4溶液恰好过量一滴,故溶液会显紫红色。
(4)由题意求得:n(Fe3+)=0.001mol,n(C2O42-)=0.003mol,代入化学式,可求得x=3。
本题难度:一般
3、实验题 (8分)病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
 ?
?
(1)该注射液中葡萄糖的物质的量浓度? ___________________。
(2)配制上述l L溶液所需的仪器有:量筒、烧杯、玻璃
棒、托盘天平、药匙、_____________、______________。(在横线上填写所缺仪器的名称)(3)在1L此溶液的配制过程中,下列操作或说法正确 的是_________________。
A.配制过程中加水时不慎超过了刻度线,把水吸出后再加水刚好至刻度线
B.用托盘天平可以准确称量计算所得葡萄糖的质量
C.用胶头滴管加水时,仰视观察凹液面与容量瓶刻度线相切会导致结果偏低
D.容量瓶使用前未干燥,不会影响实验结果
参考答案:
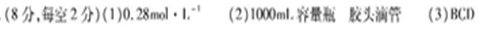
本题解析:(1)由标签可以知道,500mL葡萄糖注射液中含有的葡萄糖的质量为25g,所以该葡萄糖注射液中葡萄糖的物质的量浓度为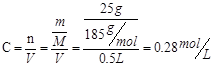
(2)配制500mL一定物质的量浓度的溶液所需的仪器除了量筒、烧杯、玻璃棒、托盘天平、药匙外,还有500mL容量瓶和胶头滴管.
(3)配制过程中若加水超过了刻度线会使浓度偏低只能倒掉重新配制,A错误;用托盘天平可以准确的称量出50g葡萄糖,B正确;胶头滴管定容时若仰视会导致加入的水超过刻度线溶液体积增大,所得到的溶液的浓度会偏小,C正确;容量瓶在操作过程中还会加入蒸馏水所以使用前有水不会对结果产生影响,D正确。
本题难度:一般
4、填空题 验需要0.1mol/LNaOH溶液450mL,根据溶液配制中情况回答下列问题:
⑴ 实验中不需要的仪器有:?
A.托盘天平? B. 烧杯? C. 500 mL容量瓶? D.玻璃棒? E.滴管? F.铁架台? G.烧瓶? H.酒精灯
⑵ 根据计算得知,所需NaOH的质量为?g
⑶ 下列操作对所配浓度有何影响(填写字母)
偏大的有?;偏小的有?;无影响的有?。
A、称量时用了生锈的砝码;?
B、将NaOH放在纸张上称量;
C、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D、往容量瓶转移时,有少量液体溅出?
E、未洗涤溶解NaOH的烧杯?
F、定容时仰视刻度线?
G、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,不再加水。
H、容量瓶底部未干燥即用来配制溶液
参考答案:(1)F、G、H
(2)1.8
(3)A、C;? B、D、E、F; G、H。
本题解析:略
本题难度:简单
5、选择题 下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( )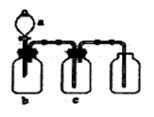

参考答案:D
本题解析:A中的NO2能被氢氧化钠溶液吸收,所以选项A不正确;B中的反应需要加热,且SO2能被酸性高锰酸钾溶液氧化,B不正确;C中氨气的密度小于空气的,应该用向下排空气法收集,C不正确,因此正确的答案选D。
点评:该题主要是考查学生对常见气体制备原理以及收集方法的了解程度,属于基础性试题的检验,难度不大。该题的关键是记住气体的制备原理和气体的性质,然后结合题意灵活运用即可。
本题难度:一般