微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 纳米材料在绝大多数同学眼里都非常神秘。某化学学习小组决定通过查阅有关资料,自己动手实验,制备纳米铁粉。
【实验原理】
(1)用硫酸亚铁、草酸两溶液制备草酸亚铁晶体(溶解度较小)。该反应的化学方程式是________。
(2)焙烧草酸亚铁晶体:FeC2O4·2H2O Fe+2CO2↑+2H2O↑
Fe+2CO2↑+2H2O↑
【操作步骤】 I.草酸亚铁晶体的制备

?①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、FeSO4、草酸等实验用品,为配制上述两溶液,缺少的仪器有____。
②若配制的FeSO4溶液略呈黄色,可能的原因是____。
③检验草酸亚铁晶体是否洗净的方法是________。
Ⅱ.纳米铁粉的制备将一根长度约为12~14 cm的玻璃管在酒精喷灯上烧制成如下图所示形状,向其中加入黄色草酸亚铁晶体。再将管口部分加热拉细,然后在酒精喷灯上均匀加热。当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
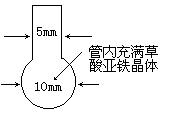
①实验中分解产生CO2所起的作用是____。
②指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间。你认为烧熔过早的后果是____;过晚的后果是___。
参考答案:(1)FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓ +H2SO4(沉淀不带2个结晶水错误)
(2)I.①1L容量瓶、胶头滴管 ;
②样品中可能含有Fe3+(蒸馏水未事先热处理、溶液配制时间较长、Fe2+被空气中的氧气氧化等合理 答案均可)
③取最后洗涤液,测其pH,若测得pH等于7,则说明已经洗涤干净;或取最后洗涤液,加入BaCl2溶液,如不出现沉淀,则说明已经洗涤干净(其他合理答案也可)
Ⅱ.①去干装置中的空气,防止红热的铁被氧化;
②晶体未能完全分解;铁被氧化
本题解析:
本题难度:一般
2、实验题 下图装置Ⅰ是实验室制乙酸乙酯的常用装置:
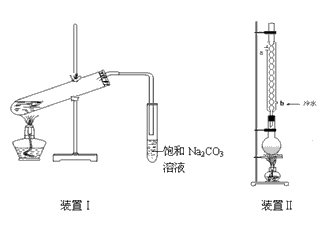
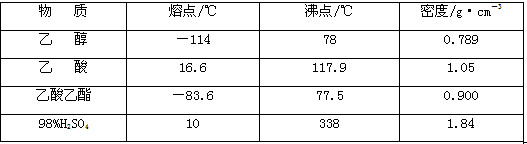
实验中所用的某些试剂及产物的相关数据如下:
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式__________,浓H2SO4的作用是___________ 。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入___________(填仪器名称),用力振荡,静置,________(填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因: _________________。
参考答案:(1)CH3CO18OH+CH3CH2OH CH3COOCH2CH3+H218O ;催化剂,吸水剂
CH3COOCH2CH3+H218O ;催化剂,吸水剂
(2)分液漏斗;分层;上;
(3)由表中数据可知,乙醇、乙酸和乙酸乙酯的沸点相差不大,在加热过程中,三者均挥发出来。采用装置Ⅱ可使反应物能冷凝回流,使反应物充分反应而提高乙酸乙酯的产率。
本题解析:
本题难度:一般
3、实验题 硬铝废料(含90%铝、2.5%镁和7.5%铜)可制取明矾 KAl(SO4)2·12H2O,某探究小组设计了下列实验。?

请回答以下问题:
(1)写出步骤②的离子方程式___________;简述用pH试纸测定溶液 pH的过程:_____________。
(2)步骤④包括三个操作环节,分别是___________、_____________、_____________。
(3)步骤⑤不直接用水洗的原因是_________________,洗涤的操作是___________。
(4)有人建议:直接将硬铝溶于稀H2SO4中,过滤:滤液中加适量K2SO4得到溶液丙,再进行后续实验。请你评价此建议的可行性_____________。
参考答案:(1)AlO2-+H++H2O=Al(OH)3↓ 或Al(OH)4-+H+=Al(OH)3↓+H2O? ;用洁净的玻璃棒沾取溶液滴到pH试纸上,待变色后,与比色卡对照,读出pH
(2)加热浓缩 ;冷却结晶 ;过滤
(3)减少产品的损失(或“减少晶体的溶解”或“明矾 在酒精中的溶解度小”等) ;往漏斗中加入洗涤剂 至浸没固体,自然流出,重复2~3次
(4)不可行 ,因为按此方法获得的溶液中还含有 Mg2+ ,最后得到的产品不纯
本题解析:
本题难度:一般
4、实验题 对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
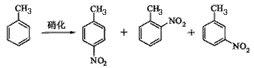
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在溶剂中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是_____________________________。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于_________________层(填“上”或"下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有___________________________。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
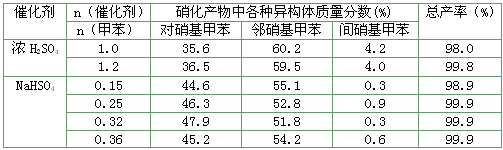
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为___________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是_____________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有__________________________、___________________________。
参考答案:(1)回收NaHSO4
(2)下;分液漏斗上口塞子未打开
(3)①0.32 ②甲苯硝化主要得到对硝基甲苯和邻硝基甲苯③在硝化产物中对硝基甲苯比例提高;催化剂用量少且能循环使用
本题解析:
本题难度:一般
5、填空题 下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓H2SO4混合共热的方法制取乙酸乙酯,反应的方程式为______
其中浓H2SO4的作用是______和______
[装置设计]甲、乙、丙三位同学分别设计下列三套实验装置:
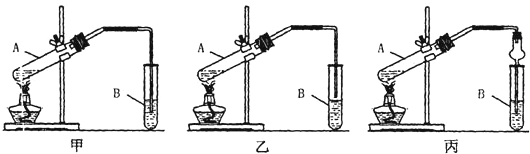
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是______(选填“甲”或“乙”),丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是______
[实验步骤]
①按我选择的装置仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓H2SO4?充分摇匀,冷却后再加入2mL冰醋酸;②将试管固定在铁架台上;③在试管B中加入适量的饱和Na2CO3溶液;④用酒精灯对试管A加热;⑤当观察到试管B中有明显现象时停止实验.
[问题讨论]
(1)步骤①装好实验装置,加入样品前还应检查______
(2)试管B中饱和Na2CO3溶液的作用是______
(3)从试管B中分离出乙酸乙酯的实验操作是______.
参考答案:[实验原理]乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,CH3COOH+C2H5OH 浓H2SO4
本题解析:
本题难度:一般