微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO +4H+
+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.2Fe2++I2===2Fe3++2I-
D.H2O2+SO2===H2SO4
参考答案:C
本题解析:解答本题可根据每个氧化还原反应中还原剂的还原性大于还原产物的还原性。
对于A项SO2是还原剂,Fe2+是还原产物,故还原性为SO2>Fe2+,A项能发生;B项中SO2是还原剂,HI是还原产物,故还原性为SO2>I-,B项正确;C项中Fe2+是还原剂,I-是还原产物,故还原性为Fe2+>I-,与已知信息矛盾,故C项错;D项中SO2是还原剂,H2O2是氧化剂,故还原性为SO2>H2O2,D项正确。
本题难度:简单
2、填空题 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
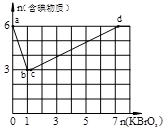
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3-+ Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。
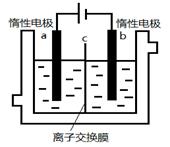
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 。
参考答案:(1)1:6;KBr
(2)BrO3—+5Br—+6H+=3Br2+3H2O(2分);
(3)不正确,该反应I2作还原剂,Br2还原产物,应得出还原性I2>Br2(合理即可)(2分)
(4)7.2mol(2分);
(5)I—+6OH——6e—=IO3—+3H2O(2分)
本题解析:(1)由图像可知b点时含碘物质的物质的量最低,则证明KI反应完全生成I2,由图可知消耗的氧化剂与还原剂物质的量之比为1:6,还原产物KBr。
(2)b→c过程中含碘物质的物质的量不变,只有一种元素的化合价发生变化只能是Br元素变价,则该过程的离子反应方程式BrO3—+5Br—+6H+=3Br2+3H2O。
(3)在氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,由反应②得出氧化性:
BrO3- >IO3- ;还原性:I2>Br2;
(4)6 molKI的硫酸溶液中加入KBrO3发生的化学反应依次为:
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
BrO3—+5Br—+6H+=3Br2+3H2O。
②2BrO3- +I2 = 2IO3-+ Br2;
可知当I一完全被氧化为IO3-,BrO3-还原为Br2时消耗KBrO3最多为6×6mol/5=7.2mol。
(5)电解目的是制备KIO3,阳极发生氧化反应,则应为I-放电生成IO3—,电极反应式为:
I—+6OH——6e—=IO3—+3H2O。
考点:了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。掌握常见氧化还原反应的配平和相关计算。了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:本题利用图像题的形式考查氧化还原反应的规律及相关计算,熟练掌握氧化还原反应的规律(强弱律、电子守恒律等)的基础上还要注意数形结合,从图中找出重要数据解决问题。
本题难度:困难
3、选择题 氯酸是一种强酸,浓度超过40%时会发生分解,该反应可表示为aHClO3―→bO2↑+cCl2↑+dHClO4+eH2O,下列有关说法不正确的是( )
A.由反应可确定氧化性:HClO3>O2
B.由非金属性:Cl>S,可推知酸性:HClO3>H2SO4
C.若氯酸分解所得1 mol混合气体的质量为45 g,则反应方程式可表示为3HClO3=2O2↑+Cl2↑+HClO4+H2O
D.若化学计量数a=8,b=3,则生成3 mol O2时该反应转移20 mol电子
参考答案:B
本题解析:根据非金属性只能比较最高价含氧酸的酸性强弱,故B错误。
本题难度:一般
4、选择题 已知在酸性溶液中的还原性强弱顺序为:SO2 >I
参考答案:
本题解析:
本题难度:一般
5、填空题 比较、分析、归纳是学习化学的有效方法。现有反应:
①Zn+CuCl2====ZnCl2+Cu;②Cu+2AgNO3====Cu(NO3)2+2Ag; ③Cl2+2NaBr====2NaCl+Br2;
④Br2+2NaI====2NaBr+I2。
(1)通过比较、分析,可以发现上述四个反应有相似之处:均属于四种基本反应类型中的______反应。再分析这四个反应前后各元素的化合价,我们还会发现一个相似之处:________________。
(2)分析反应①和②,可以得到:Zn、Cu、Ag三种金属的活动性由强到弱的顺序是_____________。根据反应③和④,用相似的思维方法,试判断将Cl2通入KI溶液中能否发生反应?若能发生反应请写出化学方程式,若不能发生反应请简述理由__________________________。
参考答案:(1)置换;反应前后均有部分元素的化合价发生变化
(2)Zn>Cu>Ag;Cl2+2KI==2KCl+I2
本题解析:
本题难度:一般