| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《水的电离平衡》高频考点巩固(2017年模拟版)(五)
(1)过滤时,应选用的上述仪器是 (填编号)。 (2)配制250ml一定物质的量浓度的NaOH溶液时,还缺少的仪器是 。 (3)做酸碱中和滴定时,还缺乏的试剂是 。 (4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的 (填编号)。 甲.酸式滴定管 乙.碱式滴定管 丙.25 mL量筒 丁.锥形瓶 (5)某同学用一份已知浓度的盐酸溶液滴定未知浓度的NaOH溶液,下列操作对滴定的结果有什么影响?(填“偏大”、“偏小”或“无影响”) ①酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗。_____________ ②滴定前,滴定管尖端有气泡,滴定后气泡消失。_____________ ③读酸式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数。_______ ④滴定到终点附近时,向锥形瓶中加入少量蒸馏水冲洗瓶壁上沾的溶液_____ 2、选择题 某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是
3、选择题 下列电离方程式书写正确的是 4、选择题 25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是 |
5、填空题 某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案: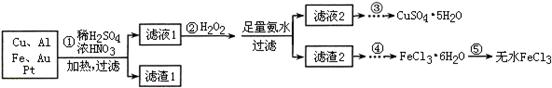
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点归纳《电解质溶液.. | ||