微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中各阳离子的浓度相同(不?考虑溶液中离子的变化),且SO42-的物质的量浓度为6mol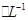 ,则此溶液最多能溶解铁粉的质量为
,则此溶液最多能溶解铁粉的质量为
A.5.6g
B.11.2 g
C.22.4g
D.33.6g
参考答案:C
本题解析:n(SO42-)=0.1L×6mol?L-1=0.6mol,CuSO4、Fe2(SO4)3、H2SO4的溶液中阳离子的浓度相同,则有n(Cu2+)=n(H+)=n(Fe3+),由于溶液中阳离子的浓度相同,所以阳离子物质的量也相同,设Cu2+、Fe3+、H+三种离子物质的量均为n,根据电荷守恒知道:2n+3n+n=0.6mol×2,由此解得n=0.2mol,Cu2+、H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,则n(FeSO4)=0.6mol,根据Fe的守恒可知,此溶液最多溶解铁粉的物质的量为0.6mol-0.2mol=0.4mol,则此溶液最多溶解铁粉的质量为0.4mol×56g/moL=22.4g,故选C
本题难度:一般
2、选择题 下列说法不正确的是( )
A.赤铁矿的主要成分是Fe2O3
B.铝土矿的主要成分是Al2O3
C.工业制备氯气主要采用电解饱和食盐水的方法
D.把铁矿石冶炼成铁的过程中,还原剂主要是焦炭
参考答案:D
本题解析:
本题难度:一般
3、选择题 某同学对铁的氧化物产生浓厚兴趣,查阅资料后制成以下卡片:
在空气中把铁灼烧至5000C就形成Fe3O4;温度再升高,可形成Fe2O3,在更高的温度下加热Fe2O3(约14000C)时,可失去氧,又得到Fe3O4。即:
|
下列说法正确的是(?)?
A.FeO、Fe2O3、Fe3O4均为黑色固体? B.反应②③均为氧化还原反应
C.热稳定性顺序为:FeO>Fe2O3>Fe3O4
D.四氧化三铁中铁元素的化合价复杂,若写成氧化物的形式,则化学式可写为FeO·Fe2O3;若视四氧化三铁为一种盐,则其化学式可写为Fe2(FeO2) 2
参考答案:B
本题解析:A 错误,Fe2O3是红棕色固体
B 正确,反应②③铁元素都有化合价的变化,所以,都是氧化还原反应。
C 错误,热稳定性顺序为:FeO>Fe3O4>Fe2O3
D 错误,四氧化三铁中铁元素的化合价复杂,若视四氧化三铁为一种盐,则其化学式可写为Fe(FeO2) 2
本题难度:一般
4、填空题 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2 xH2O)。有如下操作:
xH2O)。有如下操作:
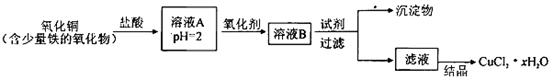
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。检验溶液A中Fe2+的最佳试剂为_____(填编号,下同)。
①KMnO4?②(NH4)2S?③NaOH?④ KSCN
(2)氧化剂可选用_________。①Cl2?②KMnO4?③HNO3?④H2O2
(3)要得到较纯的产品,试剂可选用_______________。①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是_____________(按实验先后顺序选填编号)。
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需_________,下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。

(6)为了测定制得的氯化铜晶体(CuCl2 xH2O)中的x值,某学生设计了两种实验方案:
xH2O)中的x值,某学生设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是________,理由是___________,据此计算得x=_________(用含m、n1或n2的代数式表示)。
参考答案:(1)①(2分) (2)①④(2分) (3)③④(2分) (4)②③①(2分)
(5)250ml容量瓶(2分);b(2分) (6)二(2分);晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解(2分);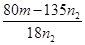 (2分)
(2分)
本题解析:(1)亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,可以用酸性高锰酸钾溶液检验亚铁离子,①正确。(NH4)2S或NaOH与三种金属阳离子均反应不能检验亚铁离子,KSCN溶液只能检验铁离子,因此②③④均不正确,答案选①。
(2)由于在氧化亚铁离子时不能再引入新的杂质,氯气的还原产物是氯离子,双氧水的生成物是水,所以①④正确;氧化剂高锰酸钾会引入Mn2+、K+以及MnO4-,硝酸会引入NO3-,②③不正确,答案选①④。
(3)在调节pH值形成氢氧化铁沉淀时,仍然不能引入新的杂质。氢氧化钠会引入钠离子,氧化亚铁会引入亚铁离子,氧化铜和碱式碳酸铜与酸反应生成铜离子、水、CO2不会引入杂质,因此答案选③④。
(4)氯化铜易溶于水,所以从滤液经过结晶得到氯化铜晶体的方法是蒸发浓缩、冷却结晶然后过滤即可,因此答案选②③①。
(5)要配制一定物质的量浓度的KMnO4溶液250mL,则除了需要天平、玻璃棒、烧杯、药匙、胶头滴管外,还需要250ml容量瓶。酸性高锰酸钾溶液具有强氧化性与酸性,应该放在酸式滴定管中,因此答案选b。
(6)由于氯化铜是强酸弱碱盐,铜离子易水解生成氢氧化铜与氯化氢,水解吸热,且生成的氯化氢具有挥发,所以晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解,因此方案一是错误的,方案二正确。n2g固体是氧化铜,物质的量是 mol,则根据铜原子守恒可知氯化铜晶体的物质的量是
mol,则根据铜原子守恒可知氯化铜晶体的物质的量是 mol,则
mol,则 mol×(135+18x)g/mol=mg,解得x=
mol×(135+18x)g/mol=mg,解得x=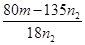 。
。
本题难度:一般
5、计算题 把12.6g的镁铝合金的粉末放入过量盐酸中,得到13.44L气体(标况下)。试计算:
(1)该合金中铝的质量分数
(2)该合金中镁和铝的物质的量之比
参考答案:(1)W(Al) = 42.9%
(2)n(Mg): n(Al)="0." 3: 0. 2=3:2
本题解析:设合金中镁和铝的物质的量分别为X mol,Y mol,
n(H2)=" 13.44/22.4" =" 0.6" mol
Mg+2H+===Mg2++H2↑
1 mol 1 mol
X mol Xmol
2Al+6H+===2Al3++3H2↑
2 mol ? 3 mol
Y mol 1.5 Y mol

(1)W(Al)= 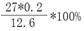 = 42.9%
= 42.9%
(2)n(Mg): n(Al)="0." 3: 0. 2=3:2
本题难度:简单