微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中各阳离子的浓度相同(不?考虑溶液中离子的变化),且SO42-的物质的量浓度为6mol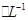 ,则此溶液最多能溶解铁粉的质量为
,则此溶液最多能溶解铁粉的质量为
A.5.6g
B.11.2 g
C.22.4g
D.33.6g
参考答案:C
本题解析:n(SO42-)=0.1L×6mol?L-1=0.6mol,CuSO4、Fe2(SO4)3、H2SO4的溶液中阳离子的浓度相同,则有n(Cu2+)=n(H+)=n(Fe3+),由于溶液中阳离子的浓度相同,所以阳离子物质的量也相同,设Cu2+、Fe3+、H+三种离子物质的量均为n,根据电荷守恒知道:2n+3n+n=0.6mol×2,由此解得n=0.2mol,Cu2+、H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,则n(FeSO4)=0.6mol,根据Fe的守恒可知,此溶液最多溶解铁粉的物质的量为0.6mol-0.2mol=0.4mol,则此溶液最多溶解铁粉的质量为0.4mol×56g/moL=22.4g,故选C
本题难度:一般
2、选择题 在KOH熔体中大气中的氧可将铬铁矿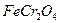 中Fe和
中Fe和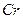 的氧化态都转化为+6氧化态,lmol
的氧化态都转化为+6氧化态,lmol 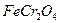 在理论上需要多少摩尔氧气使之氧化
在理论上需要多少摩尔氧气使之氧化
A.2mol
B.2.5mol
C.3mol
D.4mol
参考答案:B
本题解析:铬铁矿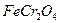 的Fe为+2价、Cr为+3价,都氧化成+6价,lmol共失去10mol电子,故需
的Fe为+2价、Cr为+3价,都氧化成+6价,lmol共失去10mol电子,故需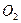 2.5mol。
2.5mol。
本题难度:一般
3、简答题 铁不能与冷、热水反应,但能与水蒸气反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4.老师用图1所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
(1)实验中使用肥皂液的作用是______.
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
| 实验编号 | 实验操作 | 实验现象
①
取少量黑色粉末X放入试管1中,加入盐酸,微热
黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生
②
向试管1中滴加几滴KSCN溶液,振荡
溶液没有出现血红色
|
根据上述实验,能确定固体中存在的物质是______;不能确定是否存在Fe3O4的原因是______
(3?)乙同学设计实验方案如图2以确定实验后试管内的固体是否存在Fe3O4:
①溶液X中发生氧化还原反应的离子方程式为______;足量氨水与金属离子反应的离子方程式为______.
②操作a包括过滤和洗涤,检验沉淀是否已经洗涤干净的操作是______.
③确定是否存在Fe3O4需要测定并记录的实验数据是______.
参考答案:(1)有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声说明有氢气生成,故答案为:检验反应中生成的H2;
(2)与盐酸反应有气泡冒出说明含有铁;不能确定是否含有Fe3O4或FeO,如果混合物中存在Fe3O4,溶于盐酸生成的 Fe3+与 Fe反应生成了 Fe2+;且溶液中的 Fe2+也有可能是 Fe与 Fe3+反应的产物,故答案为:Fe;Fe3O4溶于盐酸生成的Fe3+与Fe反应生成了Fe2+;
(3)①Fe2+能被双氧水氧化为Fe3+,反应的离子方程式为:2Fe2++2H++H2O2═2Fe3++2H2O;Fe3+能与氨水反应生成氢氧化铁沉淀,反应的离子方程式为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,
故答案为:2Fe2++2H++H2O2═2Fe3++2H2O;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
②取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则沉淀已洗干净,
故答案为:取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则沉淀已洗干净;
③固体样品m1克与红棕色固体m2克所含铁元素的物质的量相同,假设全部是FeO,
2FeO≈Fe2O3
144g? 160g
m1与m2之比=144g160g=0.9;
假设全部是Fe3O4,
2Fe3O4≈3Fe2O3
464g? ?480g?
m1与m2之比=464g480g=0.97,m1与m2之比最少应大于 0.9时,固体样品中一定存在Fe3O4,
故答案为:固体样品质量和红褐色固体的质量(其他合理答案也可);
本题解析:
本题难度:一般
4、填空题 (15分)铁及其化合物在国民经济、日常生活中占有非常 重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
(1)铁在自然界中以?态存在,其氧化物呈黑色的是?,呈红褐色的是?(填写化学式)。
(2)铁在纯氧气中燃烧的化学方程式为?。
铁在氯气中反应的产物是?。
(3)要验证一种溶液中是否含有Fe3+、Fe2+,正确的实验方法是?。
A.向甲试管中 加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
B.向乙试管中加入试液,滴入氯水,若氯水褪色,证明一定存在Fe2+。
C.向丙试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中一定存在Fe3+
(4)铁合金有下列数据:
钢
|
碳素钢(Fe、C、Mn、Si)
| 合金钢
|
低碳钢
| 中碳钢
| 高碳钢
| 碳素钢+Cr、Mn、W、Ni、Co等
|
含碳量<0.3%
| 含碳量0.3%--0.6%
| 含碳量>0.6%
|
韧性好,强度低
| 韧性好、强度好
| 硬而脆
| 具有特殊性能
|
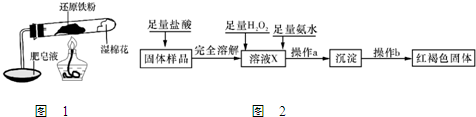
取15g某碳素钢样品,按下列实验流程进行操作:
①A、B的作用是?,
②充分加热完全反应后,D装置质量增加0.022g,该样品属于?钢。
③没有A、B装置,实验结果?(填“偏高”“偏低”“不影响”)
参考答案:(13分)
(1)游离态、化合,?FeO、Fe3O4,?Fe2O3?(各1分=3分)
(2)3Fe+2O2  Fe3O4?(2分)?
Fe3O4?(2分)?
FeCl3?(1分)
(3)AB? (2分)
(4)①除去空气中的二氧化碳和水蒸气? (2分)
②中碳? (2分)?
③偏高? (1分)
本题解析:略
本题难度:简单
5、简答题 某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色.

(1)请写出下列物质的化学式:A______、C______.
(2)在①②③④各步反应中属于氧化还原反应的有______(填序号).
(3)请分别写出反应①的化学方程式和反应③的离子方程式:①______、③______.
参考答案:已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2溶液,
(1)依据推断可知A为Fe(OH)3,C为H2O,故答案为:Fe(OH)3;H2O;
(2)反应①是氢氧化铁分解生成氧化铁和水的反应,2Fe(OH)3△.Fe2O3+3H2O,属于分解反应,不是氧化还原反应;
反应②是盐酸和氧化铁发生的复分解反应,Fe2O3+6HCl=2FeCl3+3H2O,不是氧化还原反应;
反应③是氯化铁和铁发生的氧化还原反应,Fe+2FeCl3=3FeCl2,氧化还原反应;
反应④是氢氧化亚铁和氧气水 发生反应生成氢氧化铁的也还原反应,反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,是氧化还原反应;
故答案为:③④;
(3)反应①是氢氧化铁受热分解的反应,化学方程式为2Fe(OH)3△.Fe2O3+3H2O,反应③是铁和氯化铁反应生成氯化亚铁,反应的离子方程式为2Fe3++Fe═3Fe2+,
故答案为:2Fe(OH)3△.Fe2O3+3H2O;2Fe3++Fe═3Fe2+.
本题解析:
本题难度:简单