微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,分别稀释等pH值的盐酸和醋酸,溶液pH随加入水的体积变化的曲线如右图所示。据图判断下列说法正确的是(?)
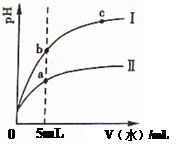
A.Ⅰ为醋酸稀释时pH变化曲线
B.溶液的导电性:b>a>c
C.取“0”处等体积的两者溶液分别加足量铁粉,放出H2的量:醋酸>盐酸
D.取5mL处等体积两者溶液分别与相同的Zn粒反应,开始时的反应速率:Ⅰ>Ⅱ
参考答案:C
本题解析:起始时醋酸和盐酸pH相等,但醋酸中有未电离的醋酸,稀释过程中会电离补充H+,所以稀释过程中盐酸pH变化大,A错误;溶液导电性与离子浓度和离子所带电荷有关,导电性a>b>c,B错误;起始时盐酸和醋酸pH相等,n(CH3COOH)>n(HCl),与足量铁粉反应放出氢气醋酸多,C正确;5mL时,c(H+)醋酸大,与锌反应醋酸快,D错误。
点评:同pH强酸、弱酸稀释相同倍数,强酸pH变化大;同pH强碱、弱碱稀释相同倍数,强碱pH变化大。
本题难度:简单
2、选择题 将0.1mol?N2O4置于1L密闭烧瓶中,然后将烧瓶放入100℃的恒温槽,烧瓶内的气体逐渐变为红棕色:N2O4(g)(无色)═2NO2(g)(红棕色)下列结论不能说明上述反应在该条件下已经达到平衡状态的是( )
A.烧瓶内气体的颜色不变,不再加深
B.N2O4的消耗速率与NO2的生成速率之比为1:2
C.NO2的生成速率与NO2的消耗速率相等
D.NO2的物质的量浓度不变
参考答案:A.该反应中,NO2为红棕色气体,容器内气体的颜色不变,说明浓度不变,反应达到平衡状态,故A正确;
B.无论是否达到平衡状态,都存在N2O4的消耗速率与NO2的生成速率之比为1:2,不能说明正逆反应速率相等,故B错误;
C.NO2的生成速率与NO2的消耗速率相等,说明正逆反应速率相等,达到平衡状态,故C正确;
D.NO2的物质的量浓度不变,反应达到平衡状态,故D正确.
故选B.
本题解析:
本题难度:简单
3、填空题 (15分)
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有?(填字母)。
a.置换反应? b.复分解反应? c.分解反应? d.化合反应
(2)图1中反应①的化学方程式是?。(3分)
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是?(填字母)。
A.升高温度? B.降低温度? C.增大压强
D.减小压强? E.加入催化剂? F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为
?mol?L-1?min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
容器编号
| n(甲)
| n(C)
| n (D)
| v正与v逆的关系
|
Ⅰ
| 0.20
| 0.10
| 0.20
| v正=v逆
|
Ⅱ
| 0.20
| 0.40
| 1.00
| ②?
|
Ⅲ
| 0.60
| 1.20
| 0.80
| ③?
|
①若方程式系数为最简整数比,则该温度下的平衡常数K=?
填写表中空格:?②??③?
参考答案:(1) c、d(各1分,写错1个扣1分,扣完2分止)
(2)4NH3+5O2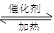 ?4NO + 6H2O(3分)
?4NO + 6H2O(3分)
(3)? B、C (各1分 ,写错1个扣1分,扣完2分止)
(4)? 0.075(2分)
(5)?①40(2分)?②<(2分)?③>(2分)
本题解析:D为红综色气体,则D是NO2。因此反应③是NO和氧气发生的氧化还原反应,即甲是氧气,C是NO。氧气和B反应生成物也是NO,这说明B是氨气,反应①属于氨的催化氧化,则A是H2O,电解水得到氢气和氧气,属于乙是氢气。
(1)②③分别是分解反应和化合反应,①是氧化还原反应。
(2)氨气发生催化氧化的反应式为4NH3+5O2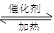 ?4NO + 6H2O
?4NO + 6H2O
(3)反应③的反应式为2NO+O2 2NO2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。
2NO2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。
(4)? 2NO+O2 2NO2
2NO2
起始量(mol)? 2? 1? 0
转化量(mol)? 2x? x? 2x
平衡量(mol)? 2-2x 1-x? 2x
所以有2-2x+1-x+2x=2.55
解得x=0.45mol
所以用甲表示的化学反应速率为
(5)正逆反应速率相等,说明反应达到平衡状态,所以平衡常数为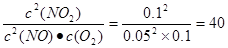 。在Ⅱ
。在Ⅱ
 >40,所以正反应速率小于逆反应速率。在Ⅲ
>40,所以正反应速率小于逆反应速率。在Ⅲ
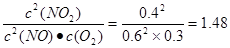 <40,所以正反应速率大于逆反应速率。
<40,所以正反应速率大于逆反应速率。
本题难度:一般
4、填空题 (13分)(1)对于下列反应:2SO2 + O2?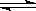 ?2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
?2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
(2)下图表示在密闭容器中反应:2SO2+O2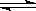 2SO3?△H<0?达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3?△H<0?达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。

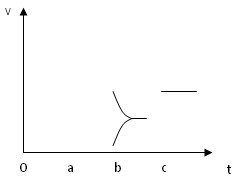
①a b过程中改变的条件可能是?;
②b c过程中改变的条件可能是?;
③若加入催化剂,请将反应速度变化情况画在c~d处。
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅黄绿色消失,溶液变成稀盐酸:?
参考答案:(1)2mol/(L·min); 1mol/(L·min);(各两分,其中数值错没分,没单位扣一分)
(2)升温;减小SO3浓度;(各一分)
 (图1分)
(图1分)
(3)在氯水中存在平衡:Cl2+H2O 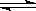 ?HCl + HClO ,HClO见光易分解为HCl和O2,使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小.HCl浓度增大,最后浅绿色消失,溶液变成稀盐酸.(3分)
?HCl + HClO ,HClO见光易分解为HCl和O2,使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小.HCl浓度增大,最后浅绿色消失,溶液变成稀盐酸.(3分)
本题解析:(1)υ(SO2)=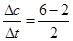 =2mol/(L·min),υ(SO2)=
=2mol/(L·min),υ(SO2)= ×υ(SO2)=1mol/(L·min)
×υ(SO2)=1mol/(L·min)
(2)①a b过程中正逆反应速率均增大,且平衡逆向移动,应该是升温
②b c过程中逆反应速率瞬间减小,平衡正向移动,应该是减小了产物浓度
③若加入催化剂,正逆反应速率同倍数增大
(3)见答案
本题难度:一般
5、选择题 可逆反应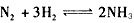 的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
[? ]
A.3v正(N2) = v正(H2)
B.V正(N2)= v逆(NH3)
C.2v正(H2) = 3v逆(NH3)
D.v正(N2) = 3v逆(H2)
参考答案:C
本题解析:
本题难度:一般