微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (共16分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g)  xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
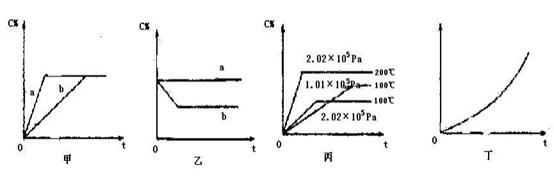
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则?曲线表示无催化剂时的情况,速率:a?b(填:大于、小于或等于)
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则?曲线表示恒温恒容的情况,此时该恒温恒容中
C%?(填:变大、变小或不变)
(3)根据丙图可以判断该可逆反应的正反应是?热反应(填:放热、吸热),计量数x的值是?;
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是??,[填:①C% ②A的转化率?③B的转化率④压强⑤c(A)⑥c(B)];升温平衡移动的方向为?。(填:左移或右移)
参考答案:(1)b?大于?(2)a?不变?(3)吸?大于2(或大于等于3)
(4)①②③④?右
本题解析:(1)对于某可逆反应来说,加入催化剂,仅仅是加快反应速率,不影响平衡的移动,所以b曲线表示无催化剂,速率大小为:a大于b;
(2)恒温恒容条件下,加入无关气体氦气,平衡不移动,则曲线a 为恒温恒容,C%不变。
(3)在相同的压强下,温度越高C%的含量越高,即可知该反应的正反应为吸热反应;在相同温度下,压强越大,C%的含量越小,即可知该反应的正反应方向为气体体积增大的反应,x的值大于2(或大于等于3)。
(4)根据图示可知,①②③④符合题意;由于该反应的正反应为吸热反应,升温平衡向右移动。
本题难度:一般
2、选择题 一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)?2C(g)达到平衡标志的是( )
①C的生成速率与C的消耗速率相等?
②单位时间内生成a?mol?A,同时生成3a?mol?B
③A、B、C的浓度不再变化?
④C的物质的量不再变化
⑤混合气体的总压强不再变化?
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a?mol?A,同时生成3a?mol?B?
⑧A、B、C的分子数之比为1:3:2.
A.②⑧
B.⑦④
C.①③
D.⑤⑥
参考答案:①C的生成速率与C的消耗速率相等时,该反应达到平衡状态,故正确;?
②无论反应是否达到平衡状态,单位时间内生成a?mol?A同时生成3a?molB,所以不能说明该反应达到平衡状态,故错误;
③A、B、C的浓度不再变化,可说明达到平衡状态,故正确;?
④C的物质的量不再变化,可说明达到平衡状态,故正确;
⑤由于反应前后气体的体积不等,恒容容器中,混合气体的总压强不再变化,可说明达到平衡状态,故正确;?
⑥混合气体的总物质的量不再变化,可说明达到平衡状态,故正确;
⑦单位时间消耗amolA,同时生成3amolB,说明正逆反应速率相等,则达到平衡状态,故正确;?
⑧A、B、C的分子数之比为1:3:2,不能用以判断是否达到平衡状态,与起始配料比以及反应的转化程度有关,故错误;
故选A.
本题解析:
本题难度:简单
3、选择题 下列说法正确的是(? )
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C.在其他条件不变时,升高温度可以使平衡向放热反应方向移动
D.在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
参考答案:B
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,A不正确;升高温度平衡向吸热反应的方向进行,C不正确;选项D不正确,改变压强平衡不一定移动,所以正确的答案选B。
本题难度:简单
4、填空题 某温度时,在一个容积为2 L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
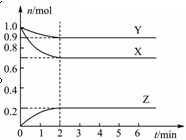
(1)该反应的化学方程式为______________;
(2)反应开始至2 min,用气体Z表示的反应速率为_____;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的________倍;
②若此时将容器的体积缩小为原来的 0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
参考答案:(1)3X+Y 2Z?(2)0.05 mol·L-1·min-1 ?(3)①? 0.9②?吸热
2Z?(2)0.05 mol·L-1·min-1 ?(3)①? 0.9②?吸热
本题解析:(1)在反应中,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,相同时间内,化学反应中各物质的物质的量变化之比等于化学剂量数之比,则化学方程式为Y+3X 2Z;(2)反应开始至2min,气体Z的平均反应速率为v=△c/△t=0.05mol/(L.min);(3)①反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol,在相同温度下,气体的物质的量之比等于压强之比,反应达平衡时,此时容器内的压强与起始压强之比为1.8mol:2.0mol=0.9;②若X、Y、Z均为气体,将容器的体积缩小为原来的 0.5倍,平衡正向移动,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为吸热反应。
2Z;(2)反应开始至2min,气体Z的平均反应速率为v=△c/△t=0.05mol/(L.min);(3)①反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol,在相同温度下,气体的物质的量之比等于压强之比,反应达平衡时,此时容器内的压强与起始压强之比为1.8mol:2.0mol=0.9;②若X、Y、Z均为气体,将容器的体积缩小为原来的 0.5倍,平衡正向移动,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为吸热反应。
本题难度:一般
5、填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于?。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
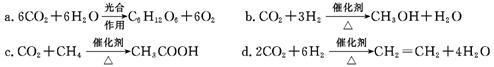
以上反应中,原子利用率最高的是?。
(3)若有4.4g CO2与足量H2恰好完全反应,生成液态甲醇和气态水,可放出4.9 kJ的热量,试写出该反应的热化学方程式_______________________________________。
(4)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器,充人1mol CO2和3molH2,进行反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡v(H2)= _____________;该温度下的平衡常数数值=__________。
(5)CO2在自然界循环时可与CaCO3反应。CaCO3是一种难溶物质,其Ksp="=" 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将4×10-4mol/L Na2CO3溶液与某浓度的CaCl2溶液等体积混合,则生成沉淀所需CaCl2溶液的最小浓度为______________。
参考答案:(1)保护臭氧层(1分)?(2) C (1分)
(3)CO2(g) +3 H2(g) 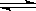 CH3OH(l) +H2O(g)?△H=-49kJ·mol-1(2分)
CH3OH(l) +H2O(g)?△H=-49kJ·mol-1(2分)
(4)0.225mol·L-1·min-1(2分)? 5.3 或 16/3(2分。对单位不做要求,若写了单位但单位错误扣除1分)
(5)2.8×10-5 mol/L(2分,无单位或单位书写错误扣除1分)
本题解析:(1)氟利昂能平衡臭氧层,所以有利于保护臭氧。
(2)反应c反应物中的原子全部转化到目标物质中,原子利用率最高。
(3)4.4g CO2与足量H2恰好完全反应,生成液态甲醇和气态水,可放出4.9 kJ的热量,则44gCO2放出的热量就是49kJ,所以热化学方程式为CO2(g) +3 H2(g) 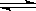 CH3OH(l) H2O(g)△H=-49kJ·mol-1。
CH3OH(l) H2O(g)△H=-49kJ·mol-1。
(4)根据图像可知起始时CO2的浓度是1.00mol/L的,说明容器容积是1L。10min时反应达到平衡状态,平衡时CO2的浓度是0.25mol/L,因此消耗CO2的浓度是0.75mol./L。根据方程式可知消耗氢气的浓度是0.75mol./L×3=2.25mol/L,所以氢气的反应速率为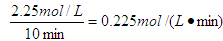 。平衡时
。平衡时
氢气的浓度是3.0mol/L-2.25mol/L=0.75mol/L,所以平衡常数为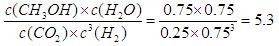
(5)等体积混合后,碳酸钠的浓度变2×10-4mol/L。根据溶度积常数的概念可知,生成沉淀所需
CaCl2溶液的最小浓度为 ,所以混合之前的浓度为2.8×10-5 mol/L。
,所以混合之前的浓度为2.8×10-5 mol/L。
本题难度:一般