|
|
|
高中化学知识点归纳《水的电离平衡》高频试题特训(2017年最新版)(三)
2017-03-05 14:52:13
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分,每空2分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②取一滴定管依次用自来水、蒸馏水洗净后,马上注入0.01mol·L-1Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3="2NaI+" 2Na2S4O6试回答下列问答:
(1)步骤①加入的指示剂是 。
(2)步骤②应使用 式滴定管。
(3)判断达到滴定终点的实验现象是 ;
(4)氯的实际浓度比所测浓度会偏小,造成误差的原因是
(5)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
|
2、选择题 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,以甲基橙为指示剂,下列有关说法正确的是
A.用碱式滴定管向锥形瓶内注入10mL氢氧化钠溶液,若开始时滴定管尖嘴有气泡,则测定结果偏高
B.边滴边振荡,直到溶液由橙色变成黄色且半分钟内不褪色为止
C.接近滴定终点时,往锥形瓶加入少量蒸馏水,则测定结果偏高
D.用酸式滴定管时,起始读数俯视,结束读数仰视,则测定结果偏高
|
3、选择题 将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是:( )
A.c(NH4+)>c(Cl
4、填空题 已知水在25℃和95℃时,其电离平衡曲线如图所示
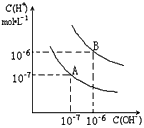
(1)则25℃时水的电离平衡曲线应为_____(填“A”或“B”),请说明理由_____________________
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______________
(3)95℃时,0.1mol/L的NaOH溶液的PH为____________
(4)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后,溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是__________________
5、填空题 (10分)某温度(t℃)时,水的离子积为KW=1×10-13,则该温度(填“大于”、“小于”或“等于”)________25℃。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
①若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是________________ 。
②若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是_______ _。
