| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《水的电离平衡》高频试题特训(2017年最新版)(四)
参考答案:淀粉溶液;碱;滴入最后一滴标准液,溶液由蓝色变成无色且半分钟内不恢复; 碱式滴定管未用Na2S2O3溶液润洗;B 本题解析:本滴定实验为利用I2+2Na2S2O3="2NaI+" 2Na2S4O6测定生成I2从而确定水样中的Cl2,故所用指示剂用来指示溶液中I2的量,故应用淀粉溶液作指示剂;步骤②中滴定管所装溶液为Na2S2O3,溶液呈碱性,故应用碱式滴定管;判断达到滴定终点的实验现象是滴入最后一滴标准液,溶液由蓝色变成无色且半分钟内不恢复;步骤②中洗涤滴定管应用水洗后再用Na2S2O3溶液润洗,该步骤没有润洗故会导致所装标准液Na2S2O3溶液浓度变小,故消耗体积变大,故会导致所测水样中Cl2浓度偏大;(5)中依据 本题难度:一般 2、选择题 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,以甲基橙为指示剂,下列有关说法正确的是 |
参考答案:A
本题解析:A、用碱式滴定管向锥形瓶内注入10mL氢氧化钠溶液,若开始时滴定管尖嘴有气泡,则所取溶液的量偏少,滴定所消耗的盐酸会偏少,根据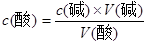 ,可知c(酸)偏高,A正确;B、未知浓度是氢氧化钠,加入甲基橙为黄色,滴定终点是由黄色变为橙红色或浅红色,B错误;C、接近滴定终点时,往锥形瓶加入少量蒸馏水,测定结果不变,C错误;D、用酸式滴定管时,起始读数俯视,结束读数仰视,造成V(酸)偏大,根据
,可知c(酸)偏高,A正确;B、未知浓度是氢氧化钠,加入甲基橙为黄色,滴定终点是由黄色变为橙红色或浅红色,B错误;C、接近滴定终点时,往锥形瓶加入少量蒸馏水,测定结果不变,C错误;D、用酸式滴定管时,起始读数俯视,结束读数仰视,造成V(酸)偏大,根据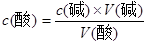 ,则测定结果c(酸)偏低,答案选A。
,则测定结果c(酸)偏低,答案选A。
考点:考查酸碱中和滴定。
本题难度:一般
3、选择题 将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是:( )
A.c(NH4+)>c(Cl
参考答案:
本题解析:
本题难度:一般
4、填空题 已知水在25℃和95℃时,其电离平衡曲线如图所示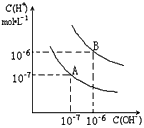
(1)则25℃时水的电离平衡曲线应为_____(填“A”或“B”),请说明理由_____________________
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______________
(3)95℃时,0.1mol/L的NaOH溶液的PH为____________
(4)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后,溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是__________________
参考答案:(1)A;25℃时,Kw=10-14
(2)10:1
(3)11
(4)a+b=14
本题解析:
本题难度:一般
5、填空题 (10分)某温度(t℃)时,水的离子积为KW=1×10-13,则该温度(填“大于”、“小于”或“等于”)________25℃。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
①若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是________________ 。
②若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是_______ _。
参考答案:
大于;①10:1;c(Na+)>c(SO42-)>c(H+)=c(OH-);②9:2;c(H+)> c(SO42-) > c(Na+) > c(OH-)
本题解析:略
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点整理《燃烧热》试.. | ||