|
高中化学知识点归纳《水的电离平衡》高频试题特训(2017年最新版)(六)
2017-03-05 14:52:13
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (6分)某学生用0.100 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,
其操作可分解为如下几步:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL;
| E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(3)判断到达滴定终点的实验现象是 。
参考答案:(1)BDCEAF (2)偏高 (3)溶液由无色变为浅红色并在半分钟不变色。
本题解析:滴定的主要操作步骤有,检漏(检查滴定管是否漏水)、润洗(用标准液润洗滴定管)、装液(往滴定管中注入标准液)、赶气泡(把滴定管中的气泡赶走)、调液面(调节液面在0刻度或0刻度以下)、装待测液加指示剂、滴定记录读数,所以操作顺序为BDCEAF。(2)若先用待测溶液润洗锥形瓶,使得待测液的总量增多,标准NaOH溶液的用量增大,则滴定结果偏高。(3)盐酸中加入酚酞,开始溶液是无色的,达到滴定终点的时候溶液变为弱碱性,酚酞遇碱变红,所以达到终点现象为溶液由无色变为浅红色并在半分钟不不变色。
考点:酸碱中和滴定的操作。
本题难度:一般
2、选择题 下列电离方程式错误的是
[? ]
A.CaCl2=Ca2++2Cl-
B.Na2SO4=2Na+ +SO42-
C.HNO3=H++NO3-
D.KClO3=K++Cl-+3O2-
参考答案:D
本题解析:
本题难度:简单
3、填空题 (11分)(1)写出下列物质在水溶液中的电离方程式:
NH3·H2O: , Ba(OH)2:___________________________,
HClO: , NaHCO3:___________________________ 。
(2)某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题: H++A-,回答下列问题:
①向溶液中加入适量NaA固体,以上平衡将向________(填“正”、“逆”)反应方向移动,溶液的PH________(“增大”“减小”“不变”)。
②若向溶液中加入适量水,以上平衡将向________(填“正”、“逆”、“不移动”)反应方向移动,溶液中c(A-)将________(填“增大”、“减小”或“不变”,下同),溶液中c(H+)将________,由水电离的的c(H+)将 。
(3)等体积的下列溶液中,阳离子的总物质的量最大的是____________。
①0.2 mol·L-1的CuSO4溶液 ②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl ④0.1 mol·L-1的Na2SO4
参考答案:(11分)(1)NH3 H2O  NH4++OH- Ba(OH)2=Ba2++2OH- NH4++OH- Ba(OH)2=Ba2++2OH-
HClO  H++ClO- NaHCO3=Na++HCO3- H++ClO- NaHCO3=Na++HCO3-
(2)逆,增大,正,减小,减小,增大(3)①
本题解析:(1)电离方程式的书写主要注意对弱电解质的电离要用可逆号;
(2)①加入NaA固体,由于同离子效应,平衡左移,氢离子浓度减小,pH增大
②加水稀释相当于“减压”,促进电离,平衡正向移动,各相关离子浓度减小,但由水的离子积不变,氢氧根离子的浓度增大,而溶液中的OH—来自于水的电离,故水电离的氢离子浓度增大
(3)如果不考虑水解的话,各溶液中阳离子量应该相等,但由于Cu2++2H2O Cu(OH)2+2H+,导致①中阳离子的量最大 Cu(OH)2+2H+,导致①中阳离子的量最大
本题难度:困难
4、选择题 下列操作中,能使电离平衡H2O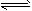 H++OH-,向右移动且溶液呈酸性的是 H++OH-,向右移动且溶液呈酸性的是
[? ]
A.向水中加入NaHSO4溶液
B.向水中加入Al2( 91Exam.orgSO4)3固体
C.向水中加入Na2CO3溶液
D.将水加热到100℃,使pH=6
参考答案:B
本题解析:
本题难度:一般
5、填空题 (1)25℃时,pH=12.0的KOH溶液中,由水电离出的C(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的C(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因:
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): , 实验室在配制FeCl3的溶液时,常将FeCl 3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解,否则得到的是浑浊的溶液。
参考答案:(1)1×10-12 1×10-2
(2)CH3COO-+H2O CH3COOH+OH- c(Na+)>c(CH3COO-)>c(H+)>c(OH-) CH3COOH+OH- c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(3)酸性 Fe3++3H2O  Fe(OH)3+3H+ HCl 抑制 Fe(OH)3+3H+ HCl 抑制
本题解析:(1)抑制水电离,含有弱根离子的盐促进水电离,碱溶液中水电离出的c(OH-)=c(H+)=10-12 mol/L,K2CO3是强碱弱酸盐,促进水电离,溶液中水电离出的c(OH-) 为水的离子积常数与c(H+)的比,所以水电离出来的c(OH-)=10?14/10?12mol/L=10-2 mol/L。(2)①醋酸钠中醋酸根离子能水解,导致溶液显示碱性,即CH3COO-+H2O CH3COOH+OH- ,②按物质的量浓度由大到小顺序排列该溶液中各种微粒为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-);(3)FeCl3的水溶液中,由于三价铁离子的水解,导致溶液呈酸性,Fe3++3H2O CH3COOH+OH- ,②按物质的量浓度由大到小顺序排列该溶液中各种微粒为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-);(3)FeCl3的水溶液中,由于三价铁离子的水解,导致溶液呈酸性,Fe3++3H2O  Fe(OH)3+3H+ ,将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,这样盐酸可以抑制三价铁离子水解; Fe(OH)3+3H+ ,将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,这样盐酸可以抑制三价铁离子水解;
考点:离子积常数;溶液pH的定义;铁的化学性质。
本题难度:困难
|