微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在密闭容器中充入4 mol X,在一定温度下4X(g) 3Y(g)+Z(g),达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是(?)
3Y(g)+Z(g),达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是(?)
A.3.4 mol
B.4 mol
C.2.8 mol
D.1.2 mol
参考答案:B
本题解析:该反应是一个等物质的量的反应,无论有多少X发生分解,体系中总物质的量守恒,所以答案选B。
本题难度:简单
2、填空题 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)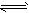 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:

(1)NO的平衡浓度c(NO)=______________。
(2)用O2表示从0~2s内该反应的平均反应速率v=_______________。
(3)下图中表示NO2变化的曲线是____________________。

(4)能说明该反应已达到平衡状态的是___________________。
a.v(NO2)=2v(O2)
b.容器内气体总物质的量保持不变
c.v逆 (NO)=2v正(O2)
d.容器内气体的密度保持不变
参考答案:(1)3.5×10-3mol·L-1?
(2)1.5×10-3mol·L-1·s-1
(3)b
(4)bc
本题解析:
本题难度:一般
3、选择题 一定条件下,在恒容密闭容器中,发生化学反应X(s)+2Y(g) 2Z(g)。下列说法中:①X、Y、Z的物质的量之比1:2:2;②混合气体的密度不在改变;③容器中的压强不再发生变化;④单位时间内生成n molZ,同时生成n mol Y上述说法中一定达到化学平衡状态的是
2Z(g)。下列说法中:①X、Y、Z的物质的量之比1:2:2;②混合气体的密度不在改变;③容器中的压强不再发生变化;④单位时间内生成n molZ,同时生成n mol Y上述说法中一定达到化学平衡状态的是
A.②③
B.①④
C.①②
D.②④
参考答案:D
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以选项①不正确;密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,所以选项②正确;根据反应式可知,反应前后体积不变,压强也是始终不变的,③不正确;选项④中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确,答案选D。
本题难度:一般
4、填空题 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-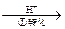 Cr2O72-
Cr2O72- Cr3+
Cr3+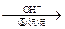 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+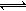 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
⑴若平衡体系的pH=2,该溶液显?色。
⑵能说明第①步反应达平衡状态的是? ?。
?。
a. Cr2O72-和CrO42-的浓度相同? b.2v(Cr2O72-)=v(CrO42-)? c.溶液的颜色不变
⑶第②步中,还原1molCr2O72-离子,需要?mol的FeSO4 7H2O。
7H2O。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
⑷用Fe做电极的原因为?。
⑸在阴极附近溶液pH升高的原因是(用电极反应解释)?,溶液中同时生成的沉淀还有?。
⑹写出Cr2O72--变为Cr3+的离子方程式___________________;
参考答案:
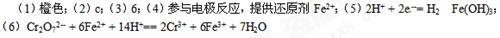
本题解析:略
本题难度:一般
5、选择题 在某一恒温体积可变的密闭容器中发生如下反应: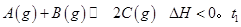 时刻达到平衡后,在
时刻达到平衡后,在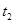 时刻改变某一条件,其反应过程如图所示。下列说法正确的是
时刻改变某一条件,其反应过程如图所示。下列说法正确的是
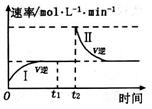
A.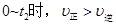
B.I、Ⅱ两过程达到平衡时,A的体积分数I>II
C.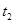 时刻改变的条件是向密闭容器中加C
时刻改变的条件是向密闭容器中加C
D.I、II两过程达到平衡时,平衡常数I<II
参考答案:C
本题解析:A、t1~t2时,反应达到平衡,正反应速率等于逆反应速率,错误;C、因为体积可变,即压强不变,新平衡逆反应速率等于原速率,因为反应前后气体的系数相等,所以t2时刻改变的条件是向密闭容器中加C ,正确;B、t2时刻改变的条件是向密闭容器中加C ,反应前后气体的系数相等且压强不变,所以A的体积分数I=II,错误;D、I、II两过程温度相同,平衡时平衡常数相等,错误。
本题难度:一般