微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.L层上的电子数为奇数的原子一定是主族元素的原子
B.元素周期表共有18列,第8列属于第ⅧB族、第17列属于第VIIA族
C.化学键的形成一定伴随着电子的转移和能量变化
D.元素周期表中,位于金属和非金属交界线附近的元素属于过渡元素
参考答案:A
本题解析:A、L层上的电子数为奇数的原子位于第二周期,一定是主族元素的原子,正确;B、元素周期表共有18列,第8列属于第Ⅷ族、第17列属于第VIIA族,错误;C、化学键的形成不一定伴随着电子的转移,如蒸发氯化钠溶液的氯化钠晶体,形成了离子键但没有电子转移,错误;D、元素周期表中,位于第ⅢB族到ⅡB族的10个纵行的元素属于过渡元素,错误。
本题难度:一般
2、填空题 (10分)A、B、C、D、E、F都是短周期元素,原子序数依次增大。
元素
| 有关信息
|
A
| 原子最外层电子数和电子层数相等
|
B
| 原子的最外层电子数是内层电子数的2倍
|
C
| 元素主要化合价为-2,原子半径为66pm
|
D
| 与A同主族,最高价氧化物对应的水化物易溶于水
|
E
| 原子半径为104pm,所在主族序数与所在周期序数之差为3
|
F
| 单质为有色的气体
|
? (1)D2C的电子式?;
(2)沸点:A2C?A2E(填“>”或“<”或“=”);
(3)E的非金属性比F ?(填“强”或“弱”),并用化学事实加以说明(用化学方程式表示)?;
(4)化合物甲由A、B、C、D四种元素组成,其化学式量为84,是焙制糕点所用发酵粉的主要成分之一。写出甲在水溶液中与盐酸反应的离子方程式??。
参考答案:(1) 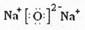 ?(2)? >
?(2)? >
(3)弱;H2S+C12="S+2HCl" (或 2Fe + 3C12 = 2FeCl3、? Fe + S = 2FeS)
(4)HCO3-+H+==CO2↑+H2O。
本题解析:略
本题难度:简单
3、选择题 有四组同族元素的物质,在101.3KPa时测定它们的沸点(0C)如下表所示:
第一组?
| He? -268.8?
| (a)? -249.5?
| ?Ar? -185.8?
| Kr? -151.7?
|
第二组?
| F2? -187.0?
| Cl2?-33.6?
| ?(b)? 58.7?
| I2? 184.0
|
第三组
| (c)? 19.4?
| ?HCl? -84.0
| ?HBr? -67.0?
| HI? -35.3
|
第四组
| H2O? 100.0?
| ?H2S? -60.2
| (d)? -42.0?
| H2Te? -1.8
|
?
下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为c分子量最大
D.第四组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
参考答案:D
本题解析:第一组物质为稀有气体的单质,都是单原子分子,则a为Ne,而不是Ne2,故A错误;氟元素一般无正化合价,则F2只表现氧化性,不表现还原性,但氯、溴、碘都有正化合价,因此Cl2、Br2、I2既能表现氧化性,又能表现还原性,故B错误;HF的相对分子质量最小,但其沸点却最高,因为HF分子间存在氢键,故C错误;非金属性:O>S>Se>Te,非金属性越强,该元素的气态氢化物越稳定,故D正确。
本题难度:简单
4、选择题 放射性同位素铀 的原子核内的中子数是
的原子核内的中子数是
A.143
B.92
C.51
D.235
参考答案:A
本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,据此可知该核素的质子数=92,质量数=235.又因为中子数+质子数=质量数,所以中子数=235-92=143,答案选A。
点评:该题是高考中的常见题型,试题以核素为载体,重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。
本题难度:简单
5、简答题 (12分)W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题:
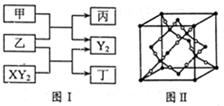
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中,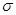 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
参考答案:(12分,每空2分)
(1)2Na2O2+2H2O==4NaOH+O2↑
(2)sp3? 1∶1? 24?
(3)O>C>H>Na
(4)2Cl2+2Na2CO3+H2O==2NaCl+2NaHCO3+Cl2O
本题解析:常温下0.01mol/L-1丙溶液PH=12,说明丙为强碱,短周期元素形成,应为NaOH,根据反应框图可知:甲为H2O,乙为Na2O2,XY2为CO2,Y2为O2,丁为Na2CO3,W、X、Y、Z是原子序数依次增大的短周期元素,分别为:H、C、O、Na。
(1)甲为H2O,乙为Na2O2,所以化学方程式为:2Na2O2+2H2O==4NaOH+O2↑
(2)甲的中心原子为O,O形成了2个σ键,还有2对孤对电子,所以杂化方式为sp3;CO2分子结构式为:O=C=O,含有2个σ键和2个π键,所以σ键与π键的数目之比为1:1;根据CO2的原子晶体晶胞图,C分子位于8个顶点,6个面心和4个晶胞内部,则含C原子:8×1/8+6×1/2+4=8,O原子都位于晶胞内部,16个,所以1个晶胞中含有24个原子。
(3)根据H、C、O、Na在元素周期表中的位置可知电负性由大到小的顺序是:O>C>H>Na
(4)次氯酸中Cl元素的化合价为+1,则次氯酸的酸酐为Cl2O,氯气与潮湿的丁反应制备次氯酸的酸酐,同时生成小苏打和食盐混合物,所以化学方程式为:2Cl2+2Na2CO3+H2O==2NaCl+2NaHCO3+Cl2O
本题难度:一般