微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (本题共12分)
沸石是一大类天然结晶硅铝酸盐的统称。自然界中已发现的沸石有30多种,较常见的有方沸石NaAlSi2O6·H2O、钠沸石Na2Al2Si3O10·2H2O和钙沸石CaAl2Si3O10·3H2O等。
完成下列填空:
23.钠原子核外共有?种不同能量的电子,这些电子分占?种不同的轨道。
24.常温下,下列5种钠盐浓度均为0.1mol·L-1的溶液,对应的pH如下:
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
|
上述盐溶液中的阴离子,结合H+能力由强到弱的顺序是____________________________。
25.NaOH在实验室中常用来进行洗气和提纯,当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________________________。
26.金属铝与一般的金属比较,在化学性质上表现出的三大特性为:?
?
?。
27.晶体硅、金刚石和金刚砂(SiC)硬度由大到小的顺序是?。
28.钙沸石CaAl2Si3O10·3H2O改写成氧化物的形式为?。
参考答案:
23.? 4? 6?(2分)
24. CO32- > CN- > ClO- > HCO3- > CH3COO-(2分)
25. c(Na+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)(2分)
26.高温下能与一些金属氧化物发生铝热反应;常温下遇浓硫酸或浓硝酸产生钝化现象;能与强碱溶液反应生成盐并放出氢气。(3分)
27. 金刚石>金刚砂>晶体硅 (1分)
28. CaO·Al2O3·3SiO2·3H2O (2分)
本题解析:23、钠原子核外电子排布为1s22s22p63s1,故有4种能量不同的电子,占据3个s轨道,1个P(有3个轨道)共6个轨道;24、盐类水解越弱越水解,水解程度越大其弱离子结合H+能力越强,故有CO32- > CN- > ClO- > HCO3- > CH3COO-;25、0.3molNaOH溶液吸收0.2molCO2,生成0.1mol的NaHCO3和Na2CO3,溶液中以CO32-第一步电离为主,故有c(Na+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+);26.高温下能与一些金属氧化物发生铝热反应;常温下遇浓硫酸或浓硝酸产生钝化现象;能与强碱溶液反应生成盐并放出氢气;27、三者为原子晶体,其硬度与键能有关,原子半径小,键长短键能大,硅原子半径大于碳原子,所以有金刚石>金刚砂>晶体硅;28、根据化学式确定元素化合价按顺序写出氧化物
本题难度:一般
2、填空题 X、Y、Z、D、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX,ZX焰色反应为黄色;Y、D同主族,可形成DY2、DY3两种分子。请回答下列问题:
(1)D在元素周期表中的位置为为?。Y、Z、D的原子半径由大到小的顺序?(用元素符号表示)。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是?(写化学式)非金属气态氢化物中述原性最强的是?(写化学式)。
(3)由Y、G两元素形成的可作饮用水消毒剂的化合物的是?(写化学式)
参考答案:(1)第三周期ⅥA族; Na、S、O?(2)HClO4? H2S?(3)ClO2
本题解析:X、Z同主族,可形成离子化合物ZX,ZX焰色反应为黄色,因此一定含有钠元素,则第IA族元素中能和钠形成化合物的是氢元素,即X是H,Z是Na。Y、D同主族,可形成DY2、DY3两种分子,所以Y是氧元素,D是S元素。G的原子序数大于S的,则G是氯元素。
(1)D在元素周期表中的位置为为第三周期ⅥA族。同周期自左向右,原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,所以Y、Z、D的原子半径由大到小的顺序 Na、S、O。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,则酸性最强的是高氯酸,化学式是HClO4。非金属性越弱,氢化物的还原性越强,则非金属气态氢化物中还原性最强的是H2S。
(3)由Y、G两元素形成的可作饮用水消毒剂的化合物的是ClO2。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
3、选择题 短周期主族元素A、B、C、D的原子序数依次增大,A、C的原子序数的差是8,A原子的最外层电子数是其次外层电子数的3倍,在同周期主族元素中B原子的原子半径最大。下列说法正确的是
A.气态氢化物的热稳定性:A<C
B.元素A与B只能形成一种化合物
C.元素B与D形成的化合物是离子化合物
D.最高价氧化物对应的水化物的酸性:C>D
参考答案:C
本题解析:A、B、C、D分别为O、Na、S、Cl。A、非金属性S<O,故H2O稳定性强于H2S ,错误;B、可以形成氧化钠和过氧化钠,错误;C、正确;D、非金属性S<Cl,H2SO4酸性弱于HClO4,错误。
本题难度:一般
4、填空题 A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2∶1的离子化合物丙。
(1)D的原子结构示意图为? ________?,丙的电子式为___________?,E在周期表中的位置为?。
(2)下列说法正确的有?。
①化合物乙分子中只含有极性共价键
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应? __________________?。
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式? ____________________________?。
(5)甲溶液显?(填“酸性”、“碱性”或“中性”),原因是?(用离子方程式表示)。
参考答案:(1)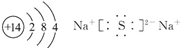 ?第三周期第ⅤA族? (2)①②③
?第三周期第ⅤA族? (2)①②③
(3)3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
(4)2NH3+H2S=2NH4++S2-或NH3+HS-=NH4++S2-或NH3+H2S=NH4++HS-
(5)酸性? NH4++H2O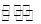 NH3·H2O+H+
NH3·H2O+H+
本题解析:A是原子半径最小的元素,A为H;B的最高价氧化物的水化物与其氢化物可以反应生成离子化合物甲,B为N,甲为NH4NO3;E与B同主族,E为P;A与D按照4∶1形成化合物乙,乙分子中含有18个电子,D为Si,乙为SiH4;F的原子序数比P大,且F的阴离子与C的阳离子差一个电子层,C与F都在第三周期,F可能为S或Cl,C与F能按照2∶1形成离子化合物丙,C只能为Na,F为S,丙为Na2S。
(1)Si的原子结构示意图为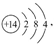 Na2S的电子式为
Na2S的电子式为 P在元素周期表中的位置为第三周期第ⅤA族。
P在元素周期表中的位置为第三周期第ⅤA族。
(2)SiH4分子中只含有极性共价键,①对;Na、Si、P、S的原子半径按照原子序数递增的顺序依次减小,所以原子半径Na>Si>P>S,②对;N的非金属性大于P,NH3的稳定性大于PH3,③对;NH4NO3中含有共价键和离子键,Na2S中只含有离子键,④错。
(3)SO2通入BaCl2和HNO3的混合溶液中,HNO3将SO2氧化为SO42-,NO3-本身被还原为NO,SO42-与Ba2+结合生成白色沉淀,反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+。
(4)以上元素组成的10电子微粒有NH3、Na+、NH4+;18电子微粒有SiH4、PH3、H2S、HS-、S2-。能相互反应的有2NH3+H2S=2NH4++S2-或NH3+HS-=NH4++S2-或NH3+H2S=NH4++HS-。
(5)NH4NO3溶液显酸性,原因是NH4+发生水解反应NH4++H2O NH3·H2O+H+
NH3·H2O+H+
本题难度:一般
5、选择题 从下列事实所得出的相应结论正确的是( )
?
| 实验事实
| 结 论
|
①
| A元素的原子半径比B元素的原子半径大
| 周期表中A位于B的下一周期
|
②
| 将CO2通入到Na2SiO3溶液中产生白色浑浊(H2SiO3)
| 酸性:
H2CO3>H2SiO3
|
③
| 将燃烧的镁条放入CO2中能继续燃烧
| 还原性:Mg>C
|
④
| 常温下白磷可自燃而氮气须在放电时才与氧气反应
| 非金属性:P>N
|
⑤
| 某无色溶液中加入硝酸酸化的硝酸钡溶液产生白色沉淀
| 原溶液一定有SO42-
|
A.③④⑤
B.①②③⑤
C.②③
D.全部
参考答案:C
本题解析:①如同一周期时左边的原子半径大于右边原子半径;④N2分子之所以稳定其原因是N2分子中含有键能较大的氮氮三键;⑤原溶液中若有SO32-也会产生白色沉淀。
本题难度:一般