| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《气体的净化、干燥、吸收与收集》高频试题预测(2017年最新版)(十)
F.将容量瓶盖紧,振荡,摇匀 (4)若实验遇到下列情况,会导致硫酸溶液的物质的量浓度偏低的是__________(填序号) ①用以稀释硫酸的烧杯未洗涤? ②量取浓硫酸的量筒未洗涤 ③摇匀后发现液面低于刻度线再加水? ④容量瓶中原有少量蒸馏水 ⑤定容时观察液面俯视 参考答案:Ⅰ③④⑧?(3分)见错无分Ⅱ(1)A、E(2分)? 500mL容量瓶(2分)(掉容积扣1分)? (2)13.6 (2分) 本题解析:Ⅰ向蛋白质溶液中加入CuSO4盐溶液会使蛋白质变性,制取乙酸乙酯用如右图所示的实验装置 本题难度:一般 4、选择题 下列有关实验的说法正确的是 参考答案:D 本题解析:测定溶液的pH时,pH试纸不能事先润湿,否则可能引起误差,A不正确。滴定管自上而下数值是逐渐增大的,所以正确的读数应该是22.35ml,B不正确。C不正确,由于氯化钠太少,且氯化银的溶度积常数大于碘化银的,所以得不到氯化银。滴定实验中,锥形瓶不能用标准液润洗,实验选项D正确,答案选D。 本题难度:简单 5、填空题 孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下: 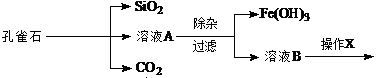 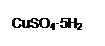 为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下: 为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
?,需调节溶液pH的范围为?。 (2)操作X包括 蒸发浓缩、冷却结晶、过滤和洗涤等。在进行该操作时,需要将溶液B再 适当酸化目的?。 (3)若向溶液B中逐滴加入NaOH溶液,刚好出现沉淀时,请写出存在的难溶物质的沉淀溶解平衡方程式为?? (4) 为准确测定溶液A中含有Fe2+的物质的量浓度,实验如下: ①取出25.00mL溶液A,配制成250 mL 溶液。 ②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.20mol/LKMnO4溶液 装入?,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。 (反应式: 5Fe2+ + MnO4— +10 H+ = 5Fe3+ + Mn2+ + 5H2O) ③ 计算溶液A中Fe2+的物质的量浓度=?mol/L (只列出算式,不做运算)。 参考答案:⑴ 升高溶液的pH,促进Fe3+水解生成Fe(OH)3沉淀(3分);3.2-4.7(2分) 本题解析:(1)要除去、Fe3+离子,就需要调节溶液的pH值,且还不能引入新的杂质,所以氧化铜的作用就是升高溶液的pH,促进Fe3+水解生成Fe(OH)3沉淀。氢氧化铜开始沉淀时的pH值是4.7,氢氧化铁完全沉淀时的pH值时3.2,所以pH的范围是3.2~4.7。 本题难度:一般 |
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学必备知识点《勒夏特列原.. | ||