微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)利用下图装置进行木炭粉和浓硫酸的反应及其产物的检验。
已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高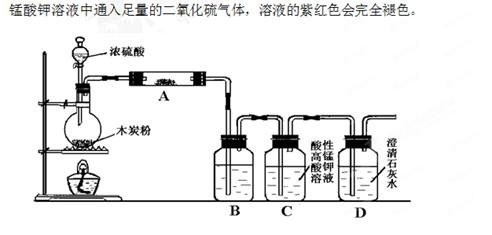
(1)组装好上述装置后,首先要进行的操作是:?。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:?。
(3)用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入试剂的名称及其作用:A中加入的试剂和作用是?、?;B中加入的试剂和作用是?、?。
(4)实验时,C中应观察到什么现象,才可以说明生成了二氧化碳:?。
参考答案:(每空2分,共14分)(1)检查装置的气密性。(2)2H2SO4(浓)+C 2SO2↑+CO2↑+2H2O
2SO2↑+CO2↑+2H2O

本题解析:(1)在有关气体的实验中,组装好仪器之后均要进行气密性的检查;(2)碳和浓硫酸在加热条件下生成二氧化碳、二氧化硫和水;(3)检验产物先用无水硫酸铜粉末检验水;再用品红溶液检验二氧化硫,除去二氧化硫之后,再通过澄清石灰水检验二氧化碳;(4)只有二氧化硫除干净了,澄清石灰水变浑浊才能说明有二氧化碳生成,根据装置图分析,只有酸性高锰酸钾颜色不褪尽才能说明二氧化硫已除干净。
本题难度:一般
2、选择题 下列关于硝酸和硫酸的叙述中,错误的是(? )
A.浓硝酸和浓硫酸都具有很强的腐蚀性、脱水性
B.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
C.稀硫酸和稀硝酸都具有氧化性
D.硫酸和硝酸都是重要的化工原料
参考答案:A
本题解析:浓硫酸有强氧化性、吸水性、脱水性,浓硝酸没有脱水性。A错误。常温情况下铝、铁在冷的浓硫酸和浓硝酸中发生钝化反应,B正确。稀硫酸有酸性也有氧化性,氢离子的氧化性,浓硝酸和稀硝酸都有氧化性,而且都是重要的化工原料。CD正确。
本题难度:简单
3、实验题 某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析,该同学改用图二的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快。
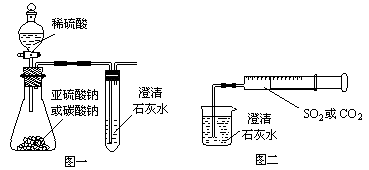 ?
?
(1)若锥形瓶内装的是亚硫酸钠,写出锥形瓶内反应的化学方程式:_______________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是_________________。写出此时试管内发生反应的总化学方程式:_____________________。
(3)用图二装置实验时,以相同速率通入CO2或SO2,SO2产生浑浊再变澄清的现象比CO2快,其原因是____________________________________。
(4)用图一进行SO2与石灰水反应的实验时,为防止SO2污染空气,应用盛有过量浓烧碱溶液的容器吸收SO2,写出容器内发生反应的离子方程式:?。
参考答案:(1)Na2SO3+H2SO4=Na2SO4+H2O+SO2?
(2)反应时直接生成了酸式盐而看不到沉淀?Ca(OH)2+2SO2=Ca(HSO3)2
(3)SO2溶解度大,且对应的亚硫酸酸性比碳酸强,通入的SO2与石灰水反应快
(4)SO2+2OH-=SO32-+H2O
本题解析:CO2跟石灰水反应生成白色沉淀CaCO3,SO2跟石灰水反应生成白色沉淀CaSO3,当气体过量时白色沉淀又溶解,所以,一般认为不能用石灰水来区别CO2和SO2。然而本题给出的结论是:通入SO2没有看到浑浊现象。这要从CO2和SO2性质的区别上来分析原因,二者在水中的溶解度及对应酸的酸性不同。防止SO2污染空气,要增加尾气吸收装置,烧碱过量时生成的盐为Na2SO3。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。探究性实验的一般思路是:1.准确地把握实验目的;2.利用已学知识,分析如何实现这个目的——实验原理;3.结合实验材料,初步确定设计对策——实验方案。
本题难度:一般
4、实验题 (12分)为验证木炭可被浓硫酸氧化成二氧化碳,选用下图中的仪器(含所盛物质)组装成套实验装置,回答下列问题。(KMnO4能吸收SO2)
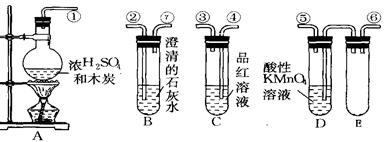
(1)在实验进行中,按气流方向从左到右的顺序,导管口的三处连接应该
是?接?,?接?,?接?。
(2)试管B,C中各有什么现象,才能表示已检验出二氧化碳?
B中?,C中?。
(3)试管D中能否用饱和NaHCO3溶液代替酸性KMnO4溶液??
说明理由:?
(4)试管E的作用是?
(5)写出A中反应的化学方程式:?
参考答案:(1)①接⑥,⑤接④,③接②;(2分)
(2)品红不褪色(2分)?澄石灰水变浑浊(2分)
(3)不能,(1分)若用NaHCO3饱和溶液, NaHCO3会发生反应:2NaHCO3+SO2==Na2SO3+H2O+CO2↑,生成CO2,因此无法确认木炭是否被氧化生成CO2(2分)?(4)防倒吸(或为安全瓶装置)(1分)
(5)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)
本题解析:(1)由于SO2也能使澄清的石灰水变混浊,所以首先除去SO2,所以连接顺序是①接⑥,⑤接④,③接②。
(2)C是检验SO2是否被完全除尽的,因此当C中品红不褪色,而B中澄石灰水变浑浊,才能说明反应中产生了CO2。
(3)由于SO2能和碳酸氢钠反应产生CO2,方程式为2NaHCO3+SO2==Na2SO3+H2O+CO2↑,因此无法确认木炭是否被氧化。所以不能用碳酸氢钠来代替顺序高锰酸钾溶液。
(4)CO2在石灰水反应时,溶液有可能倒流,所以E的作用是防倒吸(或为安全瓶装置)。
(5)方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
本题难度:一般
5、选择题 对下列事实的解释错误的是
A.在蔗糖中加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性
B.浓H2SO4和Cu加热反应,表现浓H2SO4的强氧化性和酸性
C.常温下,浓硫酸可以用铝罐贮存,说明铝与浓H2SO4不反应
D.蓝色硫酸铜晶体加入浓H2SO4后变白,说明浓H2SO4具有吸水性
参考答案:C
本题解析:蔗糖中无水分子,浓H2SO4使蔗糖中的氢、氧元素按水的组成脱去,即为脱水性,故A正确;生成二氧化硫,说明浓硫酸表现氧化性(+6价降低到+4价),铜是不活泼金属,能反应,说明浓H2SO4有强氧化性;生成硫酸铜(盐)和水,表现浓H2SO4的酸性;故B正确;
常温下,铝与浓H2SO4发生钝化,即在表面生成致密的氧化膜,阻止内部金属继续反应,故C错误;CuSO4.5H2O(蓝色晶体)失水变成CuSO4(白色粉末),说明浓H2SO4具有吸水性,故D正确
本题难度:一般