| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《实验方案的设计与评价》高频试题预测(2017年最新版)(二)
(1)简述如何检查该装置的气密性:______. (2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度.你认为是否可行?请简述原因.______. (3)实验②、③中,量气管中的液体最好分别是______、______.(只选一种) A.H2OB.CCl4C.饱和Na2CO3溶液?D.饱和NaHCO3溶液 (4)本实验应对量气管多次读数,读数时应注意: ①恢复至室温,②______,③视线与凹液面最低处相平. (5)实验④获得以下数据(所有气体体积均已换算成标准状况)根据上述合理数据计算镁铝合金中铝的质量分数______. 编号 镁铝合金质量 量气管第一次读数 量气管第二次读数 1 1.0g 10.0mL 347.5mL 2 1.0g 10.0mL 335.0mL 3 1.0g 10.0mL 344.5mL |
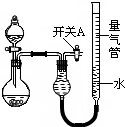
参考答案:(1)关闭开关A和分液漏斗活塞,微热烧瓶,量气管左端液面升高,说明气密性良好
(2)一氧化氮与氧气反应生成二氧化氮,二氧化氮可与水反应生成一氧化氮和硝酸;装置中有空气,一氧化氮会与装置中的空气反应,生成的二氧化氮溶于水并与水反应,使测得的一氧化氮体积不准,所以不可以通过实验收集并测量NO气体的体积来探究铜样品的纯度;
故答案为:不可行.因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准.
(3)实验②中氨气极易溶于水,所以量气管中液体不能选用水及水溶液,只能选和氨气不反应的四氯化碳;实验③中的气体是二氧化碳,二氧化碳能溶于水,四氯化碳有毒,碳酸钠和二氧化碳能反应,二氧化碳和饱和的碳酸氢钠不反应,所以选取饱和碳酸氢钠溶液.
故答案为:B、D.
(4)根据PV=nRT,为保证测出来的气体体积是当时大气压下的体积,在读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,因为相平说明两边液面上的压强是一样的,这样测出来的气体体积才是当时大气压下的体积,③视线与凹液面最低处相平,俯视或仰视会造成误差;?
故答案为:使量气管两端液面相平.
(5)铝和氢氧化钠反应生成氢气的体积=347.5mL+335.0mL+344.5mL-10.0mL×33=332.3mL=0.3323L,
设生成0.997L氢气,需铝的质量为x
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54g?67.2L
x? 0.3323L
x=0.27g
所以铝的质量分数为0.27g1.0g×100%=27%
故答案为:27%.
本题解析:
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点总结《钠及其化合.. | ||