微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业上对海水资源综合开发利用的部分工艺流程如图1所示.

(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性.请写出加入Na2CO3溶液后相关化学反应的离子方程式:______.
(2)本工艺流程中先后制得Br2、CaSO4、Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?______(填“能”或“否”),原因是______.
(3)氯化钠是重要的氯碱工业化工的原料.电解饱和食盐水常用离子膜电解槽和隔膜电解槽.离子膜和隔膜均允许通过的分子或离子是______.
A.Cl-?B.Na+?C.OH-?D.Cl2
(4)饱和食盐水电解时与电源正极相连的电极上发生的反应为______,与电源负极线连的电极附近溶液pH______(变大、不变、变小).
(5)氯化钠的可用于生产纯碱,我国化学家侯德榜改革国外生产工艺,生产流程简要表示如图2:

①上述生产纯碱的方法称______,副产品的一种用途为______.
写出上述流程中X物质的分子式______.使原料氯化钠的利用率从70%提高到90%以上,主要是设计了______(填上述流程中的编号)的循环.从沉淀池中取出沉淀的操作是______.
②合成氨原料气中氮气制备的方法之一为______,另一原料气氢气的制取化学方程式为______.
③沉淀池中发生的化学反应方程式是______.要实现该反应,你认为应该如何操作:______;
④为检验产品碳酸钠中是否 含有氯化钠,可取少量试样溶于水后,再滴加______.
参考答案:(1)Na2CO3可以把过量的钡离子转化为沉淀:Ba2++CO32-=BaCO3↓,Na2CO3可以和钙离子结合生成沉淀:Ca2++CO32-=CaCO3↓;
故答案为:Ba2++CO32-=BaCO3↓;Ca2++CO32-=CaCO3↓;
(2)工艺流程中先后制得Br2、CaSO4和Mg(OH)2,不能沉淀Mg(OH)2,硫酸钙为微溶物,如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,使产品不纯.
故答案为:否.如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯;
(3)电解饱和食盐水,用石墨做电极,电解槽离子膜或隔膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阳极生成氯气,
故答案为:B;
(4)饱和食盐水电解时与电源正极相连的电极上发生的反应为溶液中氯离子失电子发生氧化反应,2Cl--2e-=Cl2↑;阴极和电源负极相连,溶液中氢离子得到电子生成氢气,破坏了阴极附近水的电离平衡,氢氧根离子浓度增大;与电源负极相连的电极附近溶液PH增大;
故答案为:2Cl--2e-=Cl2↑;增大;
(5)①目前工业制碱方法有二:氨碱法和联合制碱法.题中方法由我国侯德邦所创,称为侯氏制碱法,也称为联合制碱法,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,得到碳酸氢钠同时得到氯化铵,故副产物为氯化铵,氯化铵可用来制作化肥,在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用;因为氯化钠最后剩余在母液中,所以循环I是氯化钠的循环;分离沉淀的方法是过滤.
故答案为:联合制碱法,做化肥;CO2;I; 过滤
②合成氨原料气中氮气制备的方法之一是分离液态空气方法分离得到氮气,氢气用碳和水蒸气反应生成;反应化学方程式为:C+H2O?高温?.?CO+H2,CO+H2O?高温?.?CO2+H2;
故答案为:液体空气分离方法,C+H2O?高温?.?CO+H2,CO+H2O?高温?.?CO2+H2;
③从流程图可以看出,沉淀池中加入的反应物有氨气、二氧化碳、氯化钠,根据生成物是碳酸氢钠,可推出反应物有水,同时可知碳酸氢钠为沉淀.
反应原理首先是氨气、二氧化碳和水反应生成碳酸氢氨,然后碳酸氢氨和氯化钠发生复分解反应交换成分生成碳酸氢钠晶体和氯化铵.为增大二氧化碳的吸收,应先向饱和氯化钠饱和溶液中通入氨气,再通入二氧化碳;
故答案为:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NH4Cl+NaHCO3↓;向氨化的饱和氯化钠溶液中通入二氧化碳气体得到碳酸氢钠晶体;
④检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,
故答案为:用硝酸酸化的硝酸银,观察产生白色沉淀;
本题解析:
本题难度:一般
2、填空题 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤,水洗除去其中的Cl-再烘干、焙烧除去水分得到固体TiO2。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定
Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为______________________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是______________________________。
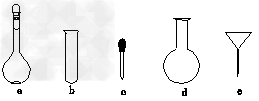
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是___________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。
(4)滴定终点的现象是_________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M?g/mol)试样w?g,消耗c?mol/L?NH4Fe(SO4)2标准溶液V?mL,则TiO2质量分数表达式为______________________________________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果______。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果________。
参考答案:(1)TiCl4+(x+2)H2O TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
(2)取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除尽
(3)抑制NH4Fe(SO4)2水解;a、c
(4)溶液变为红色
(5)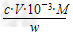 ×100%
×100%
(6)①偏高;②偏低
本题解析:
本题难度:一般
3、选择题 海带中含碘元素,从海带中提取碘有如下步骤:①通入足量Cl2 ②将海带焙烧成灰后加水搅拌
③加CCl4振荡 ④用分液漏斗分液 ⑤过滤 合理的操作顺序是
[? ]
A.①②③④⑤
B.②⑤①③④
C.①③⑤②④
D.②①③⑤④
参考答案:B
本题解析:
本题难度:一般
4、实验题 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是_______________,洗涤沉淀并判断沉淀是否洗净的操作是_____________________。
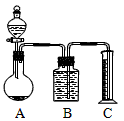
(2)乙组:气体分析法把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,选用该溶液后实验结果还是不准确,原因是_____________。
(3)请你设计一个与甲、乙两组操作不同的实验方案,测定混合物中Na2CO3的含量。方法:_________。用到的主要试剂:_______(至少2种)。用到的玻璃仪器:____________(至少2件)
参考答案:(1)静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2已过量 ;沿玻棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次,然后向滤液(洗涤液)中滴加AgNO3溶液判断是否洗净。
(2)饱和NaHCO3溶液 ;从A出来的气体中混有HCl,会与NaHCO3反应生成CO2
(3)滴定分析法(或中和滴定法、滴定法、用标准盐酸滴定一定量的混合物等) ;标准盐酸溶液、指示剂(甲基橙、酚酞) ;酸式滴定管、锥形瓶、 烧杯
本题解析:
本题难度:一般
5、选择题 为了除去已滤去泥沙的粗盐水中的?Ca2+、Mg2+、SO42-,可将该粗盐水进行下列五项操作.其中正确的操作顺序是( )
①过滤?②加过量NaOH溶液?③加适量盐酸?④加过量?Na2CO3溶液?⑤加过量?BaCl2溶液.
A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.⑤②④③①
参考答案:C
本题解析:
本题难度:一般