微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下实验能获得成功的是
[? ]
A.用乙醇和乙酸混合共热制取乙酸乙酯
B.将铁屑、溴水、苯混合制溴苯
C.在苯中滴入浓硝酸制硝基苯
D.将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
参考答案:D
本题解析:
本题难度:简单
2、简答题 无水硫酸铜在加热条件下能发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.某学生试图用下图所示装置来确定该化学反应中各物质的计量关系
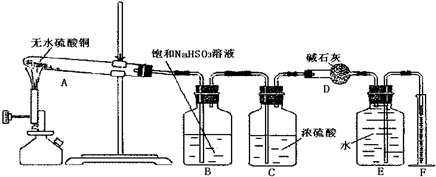
试回答:
(1)加热过程中,试管A中发生的实验现象为______.
(2)装置E和F的作用是______;
(3)该学生使用装置B的本意是除去混合气体中的三氧化硫以提纯氧气,他的做法正确吗?为什么?______
(4)该学生利用上述装置将一定质量的无水硫酸铜置于A中加热使其分解,最后测得氧气的体积偏小,其原因可能是______(填序号)
A.无水硫酸铜未完全分解
B.实验结束时装置A中残留有气体
C.S
被NaHS溶液吸收时产生了S气体
D.最后读量筒中的读数时,E中的液面低于F中的液面
(5)另一学生将4.8g无水硫酸铜充分加热使其完全分解后,用正确的实验方法除去了生成物中的二氧化硫和三氧化硫,最后测出氧气的体积为224mL(标准状况).据此可计算出二氧化硫为______mol,三氧化硫为______mol.
(6)由上述实验数据可知无水硫酸铜受热分解的化学方程式为:______.
参考答案:(1)无水硫酸铜在加热条件下能发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气,无水硫酸铜是白色固体,氧化铜为黑色,
故答案为:白色固体变黑;
(2)EF是排水量气装置,难溶于水的气体体积可以利用排水量气装置测定体积,装置A生成的气体通过亚硫酸氢钠溶液吸收氧气;吸收三氧化硫生成二氧化硫,浓硫酸吸收三氧化硫和水蒸气;通过碱石灰吸收二氧化硫,则最后测定的是氧气的体积,
故答案为:测出产生O2的体积;
(3)使用装置B的本意是除去混合气体中的三氧化硫以提纯氧气,但气体通过饱和亚硫酸氢钠溶液中,氧气会被还原吸收;
故答案为:不正确,O2能被NaHSO3溶液吸收;
(4)利用上述装置将一定质量的无水硫酸铜置于A中加热使其分解,最后测得氧气的体积偏小,
A、无水硫酸铜未完全分解,生成氧气减少,故A符合;
B、实验结束时装置A中残留有气体可以有氧气,故B符合
C、生成的二氧化硫会被碱石灰吸收不影响氧气体积,故C不符合;
D、量筒中液面是凹液面,所以读量筒中液体体积时,视线与液体的凹液面相平,否则会造成误差;最后读量筒中的读数时,E中的液面低于F中的液面,读出的体积减小,故D符合;
故选ABD;
(5)依据反应生成的二氧化硫和氧气之间存在电子守恒,计算二氧化硫物质的量,氧气224mL(标准状况)物质的量为0.01mol,电子转移0.04mol,CuSO4~SO2~2e-;计算得到二氧化硫物质的量为0.02mol,依据硫酸铜质量换算物质的量=4.8g160g/mol=0.03mol,结合硫元素守恒计算三氧化硫物质的量为0.01mol,
故答案为:0.02;0.01;
(6)依据(5)计算得到生成物的物质的量写出化学方程式为3CuSO4═3CuO+SO3↑+2SO2↑+O2↑,故答案为:3CuSO4═3CuO+SO3↑+2SO2↑+O2↑.
本题解析:
本题难度:一般
3、简答题
| 阳离子 | Na+?H+?Ba2+
阴离子
OH-?CO32-?SO42-
|
现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的名称:X______.
(2)B溶于水后的电离方程式为______.鉴别B中阴离子的实验操作方法是______.
(3)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:______.
B溶液与E溶液反应:______.
B与C反应至溶液呈中性:______.
(4)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为______.
参考答案:生成的气体只有CO2符合,发生的反应为?2H++CO32-=H2O+CO2↑,CO2气体可以和C溶液反应生成沉淀D,
则C为Ba(OH)2,沉淀D为BaCO3,与B溶液反应,则B为NaHSO4,所以A为Na2CO3,
(1)生成的气体只有CO2符合,发生的反应为?2H++CO32-=H2O+CO2↑,故答案为:CO2;?
(2)CO2气体可以和C溶液反应生成沉淀D,则C为Ba(OH)2,沉淀D为BaCO3,与B溶液反应,则B为NaHSO4,所以A为
Na2CO3,在溶液中完全电离生成Na+、H+和SO42-,电离方程式为NaHSO4=Na++H++SO42-,检验SO42-时,取B溶液少量,先加盐酸,无明显现象,再加BaCl2溶液产生白色沉淀,
故答案为:NaHSO4=Na++H++SO42-;取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-;
(3)A为Na2CO3,B为NaHSO4,A溶液与B溶液反应的实质为:CO32-+2H+=CO2↑+H2O,E为碳酸钡,B为NaHSO4,B溶液与E溶液反应实质是:BaCO3+2H++SO42-=BaSO4↓+CO2↑+H2O,C为Ba(OH)2,B溶液与C溶液反应至中性的离子方程式为
2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,
故答案为:故答案为:CO32-+2H+=CO2↑+H2O;BaCO3+2H++SO42-=BaSO4↓+CO2↑+H2O;2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓;
(4)D与E的混合物ag,加入足量盐酸,发生的反应为BaCO3+2HCl=CO2↑+BaCl2+H2O,
n(CO2)=b22.4mol,n(BaCO3)=n(CO2)=b22.4mol,
m(BaCO3)=b22.4 mol×197g/mol=197b22.4g,
m(BaSO4)=ag-197b22.4g,
所以:w(BaSO4)=a-197b22.4a×100%=1-197b22.4a,故答案为:1-197b22.4a.
本题解析:
本题难度:一般
4、填空题 某无色溶液可能是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3、(NH4)2SO4溶液中的两种或两种以上混合而成.取该溶液少许于试管,向其中加入H2SO4,有白色沉淀生成,继续加入H2SO4时沉淀又完全消失,整个实验过程中无气体产生,则原溶液是由______?和______?混合而成.实验过程中有关的离子反应方程式是______.
参考答案:无色溶液说明无三价铁离子,即不含Fe2(SO4)3,碳酸根离子与钡离子、镁离子不能同时存在;硫酸根与钡离子不能同时存在,氢氧根离子与镁离子不能同时存在,取该溶液少许于试管,向其中加入H2SO4,有白色沉淀生成,可能是硫酸钡白色沉淀,但继续加入H2SO4时沉淀又完全消失,整个实验过程中无气体产生,说明不是硫酸钡沉淀,证明不含BaCl2;同时证明不含Na2CO3;剩余物质中能与硫酸反应生成白色沉淀的只能是NaOH和AlCl3混合时氢氧化钠过量,最终形成的溶液是偏铝酸钠溶液,碱过量也说明了MgCl2不含有,因为镁离子会和氢氧根离子形成难溶的白色沉淀,所以原溶液是氢氧化钠溶液和氯化铝溶液混合而成的.实验过程中的离子反应方程式分别为:Al3++4OH-=AlO2-+2H2O;H2O+AlO2-+H+=Al(OH)3↓;
Al(OH)3+3H+=Al3++3H2O;
故答案为:Al(OH)3溶液? NaOH溶液? Al3++4OH-=AlO2-+2H2O;H2O+AlO2-+H+=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O;
本题解析:
本题难度:一般
5、选择题 下列相关实验不能达到预期目的是( )
| 相关实验 | 预期目的
①
将SO2通入溴水,溴水褪色后加热观察能否恢复原色
验证SO2漂白的可逆性
②
将氯水加入淀粉KI溶液中
验证Cl的非金属性比I强
③
在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率.
比较同周期金属元素的金属性强弱.
④
利用电解质溶液的导电性装置,检测AlCl3溶液的导电性
证明AlCl3是离子化合物
|
A.仅①
B.①④
C.②③
D.③④
参考答案:B
本题解析:
本题难度:简单