微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 在一个小烧杯里加入少量碘,用一个表面皿盖在小烧杯上,并在表面皿上加少量冷水。把小烧杯放在石棉网上加热,观察实验现象。
(1)并在表面皿上加少量冷水的作用是____________________________ 。
(2)观察到的实验现象是______________________________________ 。
(3)在表面皿上是碘的______________________________ (填“晶体”、“非晶体”)。
(4)这种方法是___________________________ ,制取晶体的方法还有_________________________ 。
参考答案:(1)冷却碘蒸汽
(2)烧杯中充满紫色的蒸汽,在表面皿上有紫黑色的警惕
(3)晶体
(4)凝华;熔融态物质凝固、结晶
本题解析:
本题难度:一般
2、实验题 某化学研究性学习小组拟采用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜并测定样品中氧化铜的质量分数,其实验流程如图所示:
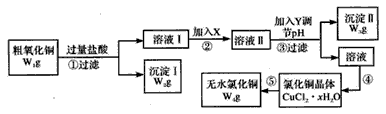
实验过程中的pH调节为:
请回答以下问题:
(1)步骤①、③过滤操作中,除用到仪器:铁架台(带铁圈)、漏斗、烧杯外,还需要使用的仪器用品有________。
(2)步骤①中发生的离子反应方程式为________、____。
(3)步骤②溶液I中加入试剂X可以是____(填下列试剂的编号)。
A.氢氧化钠
B.氯水
C.碱式碳酸铜
D.氧化铜
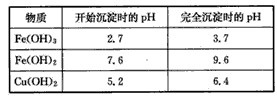
(4)步骤③中将溶液pH调节到的范围是____。
(5)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2·xH2O,其原因是____ 。
(6)经检测,CuCl2·xH2O中含水28. 6%,则CuCl2·xH2O中x的值为____。
(7)若步骤④中80%的氯化铜转入晶体,其余各步转化都是完全的,请根据流程图中表示的质量数据,写出 样品中氧化铜质量分数的计算式。
参考答案:(1)玻璃棒、滤纸
(2)CuO+2H+==Cu2++H2O;FeO+ 2H+=Fe2++H2O
(3)B
(4)3. 7~5.2
(5)干燥HCl的气 流既可抑制Cu2+的水解,还能带走CuCl2·xH2O受热产生的水 汽
(6)3
(7)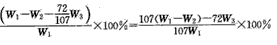
本题解析:
本题难度:一般
3、填空题 纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
方案一:纯碱样品
测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放人坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为:______.
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是:______.

方案二:纯碱样品溶液测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是:______.
(2)沉淀经干燥后称量为m2g,则该样品中碳酸钠的质量分数为:______.
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际______(填“偏高”、“偏低”或“不变”).
方案三:纯碱样品测定生成二氧化碳的质量
(1)本实验采用vk图装置,C中盛放的物质是______.
(2)反应前后都要通人N2,反应后通入N2的目的是:______

参考答案:方案一:
(1)坩埚中发生反应的化学方程式为:2NaHCO3=Na2CO3+CO2↑+H2O
故答案为:2NaHCO3=Na2CO3+CO2↑+H2O.保证NaHCO3全部分解.
(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解.
故答案为:加热至恒重,以保证NaHCO3全部分解.
方案二:
(1)碳酸钙沉淀会附着氯化钠、氯化钙,过滤后需用蒸馏水洗涤.
故答案为:用蒸馏水洗涤.
(2)沉淀经干燥后称量为m2g,碳酸钙物质的量等于碳酸钠物质的量,所以碳酸钠的质量为m2100×106g,则该样品中碳酸钠的质量分数为m2100×106gm1g×100%=106m2m1%.
故答案为:106m2m1%.
(3)在一定量样品中加入足量Ca(OH)2溶液,此时分别发生如下反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均产生CaCO3沉淀,根据样品的总量和生成CaCO3沉淀的量,可以计算碳酸钠质量,就可得出纯碱的质量分数.故用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数不变.
故答案为:不变.
方案三:
(1)C装置干燥二氧化碳,所以C中盛放的物质是浓硫酸.
(2)该方案关键是要获得产生的CO2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通人
N2,反应后通入N2的目的是:排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收.
故答案为:排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收.
本题解析:
本题难度:一般
4、简答题 一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.
[探究目的]
从废液中回收铜,并重新得到FeCl3溶液.
[资料获悉]
①3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O
②有关金属离子从开始沉淀到沉淀完全时溶液的pH:
Fe3+:2.7~3.7Cu2+:5.2~6.4Fe2+:7.6~9.6
[探究思路]
(1)先确定废液的组成及各金属离子的浓度;
(2)选择合适试剂回收铜,并重新得到FeCl3溶液.
[实验探究]
取几滴废液于试管中加水稀释后,滴加KSCN溶液出现血红色,可知废液中除含有Fe2+、Cu2+外,还含有Fe3+.
甲同学取10mL废液,向其中加入足量的AgNO3溶液,得到的沉淀经过滤、洗涤、干燥,称重8.61g.乙同学另取10mL废液,加入某试剂将pH调至4.0,使其中Fe3+转化为Fe(OH)3沉淀,而Fe2+、Cu2+仍留在废液中,沉淀经过滤、洗涤、灼烧,冷却后称重得0.32g.
通过计算可知废液中c(Fe3+)=______mol/L,c(Fe2+)=______mol/L,c(Cu2+)=______mol/L.
[交流讨论]
如何回收1L废液中含有的铜,并重新得到FeC13溶液?
丙同学认为应该先向废液中加入wg铁粉[w=c(Cu2+)×1L×56g/mol],使之充分反应置换出铜,过滤,得金属铜.再向滤液中加入适量的稀硝酸,将Fe2+全部氧化为Fe3+,并进行尾气处理,即可达实验目的.有些同学认为丙同学的方案不可行,请你评价丙同学的方案有哪些不妥之处?(不一定填满)
(1)______(2)______(3)______
该小组同学根据讨论得到的合理方案进行操作,最终达到了预期目的.(方案内容略)
[拓展延伸]
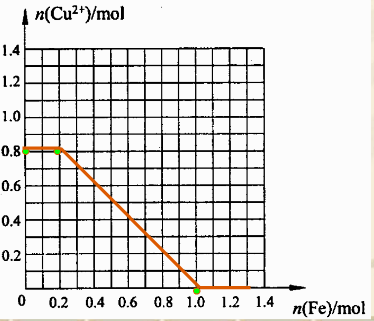
请画出1L废液中加入铁粉的物质的量与废液中铜离子的物质的量的关系曲线,并利用图象计算,当铜离子的物质的量减少一半时,加入铁粉的质量是______g.

参考答案:[实验探究]甲同学实验操作的到的8.61g沉淀为氯化银,物质的量是0.06mol,则Cl-物质的量为0.06mol,乙同学pH调至4.0时,只有Fe3+沉淀而且沉淀完全,沉淀为氢氧化铁,灼烧得到0.32gFe2O3,物质的量为0.002mol,根据元素守恒可知Fe3+的物质的量为0.004mol,c(Fe3+)=0.004mol0.01L=0.4 mol?L-1;由2Fe3++Cu═Cu2++2Fe2+可知2n(Cu2+)=n(Fe2+),由电荷守恒可知,3n(Fe3+)+2n(Cu2+)+2n(Fe2+)=n(Cl-),即n(Cu2+)+n(Fe2+)=12(0.06mol-0.004mol×3)=0.024mol,n(Cu2+)+n(Fe2+)=n(Cu2+)+2n(Cu2+)=0.024mol,求得:n(Cu2+)=0.008mol,c(Cu2+)=0.008mol0.01L=0.8 mol?L-1,则
n(Fe2+)=2n(Cu2+)=0.016mol,c(Fe2+)=0.016mol0.01L=1.6 mol?L-1,
故答案为:0.4;1.6;0.8;
[交流讨论]:根据上面计算可知,c(Fe3+)=0.4 mol?L-1,c(Cu2+)=0.8 mol?L-1,进入wg铁粉,铁粉质量不足,溶液中有残留的铜离子;使用硝酸做氧化剂,反应后引进了杂质硝酸根离子,
故答案为:加入铁粉不足,溶液中有残留的Cu2+;用HNO3氧化,会引入新的杂质NO3-;
[拓展延伸]:上述1L废液含有n(Fe3+)=0.4mol,n(Cu2+)=0.,8mol,铁先发生Fe+2Fe3+=3Fe2+ 后发生Cu2++Fe=Fe2++Cu,0.4molFe3+消耗0.2molFe,此时n(Cu2+)=0.8mol,得到坐标(0.2,0.8),然后Cu2++Fe=Fe2++Cu反应,消耗铁的物质的量与Cu2+减少的物质的量相等,可得到如下几个坐标(0.4,0.6)、(0.6,0.4)(0.8,0.2)、(1.0,0),根据以上关系可以画出1L废液中加入铁粉的物质的量与废液中铜离子的物质的量的关系曲线:
 ;
;
当铜离子物质的量变为0.4mol时,加入铁的物质的量为0.6mol,质量为0.6mol×56g/mol=33.6g,
故答案为: ;33.6.
;33.6.
本题解析:
本题难度:简单
5、简答题 某化学小组的同学到实验室学习.如图1在实验桌上摆有下列仪器:
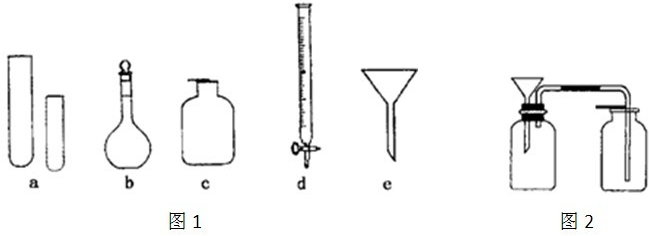
(1)指导教师要求同学们写出仪器的名称,甲同学书写的答案如下表,请你找出其中的错误,将改正后的名称填写在下表中(若正确,则该空不需要填写).
| 仪器编号 | a | b | c | d | e
名称
试管
溶量瓶
集气瓶
碱式滴定管
普通漏斗
改正的名称
______
______
______
______
______
|
(2)关于e的用途,乙同学说:组成防倒吸装置.你还能说出其他两种用途吗?
①______;
②______.
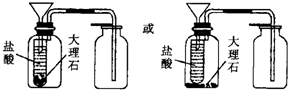
(3)丙同学想用图2装置以大理石和稀盐酸反应制取CO2.教师指出,这需要太多的稀盐酸,造成浪费.该同学选用了上面的一种仪器,加在装置上,解决了这个问题.请你把该仪器画在图中合适的位置.
参考答案:(1)b中汉字写错,应该为容量瓶;d仪器是酸式滴定管,酸式滴定管有活塞,碱式滴定管下端有橡胶管,橡胶管内有玻璃球.
故答案为:仪器编号bd名称改正的名称容量瓶酸式滴定管(2)漏斗的下口较细,所以它的用途有①往细口容器中加液体;②组成过滤装置.
故答案为:①往细口容器中加液体;②组成过滤装置.
(3)漏斗颈太短,产生的二氧化碳气体会从漏斗处泄露,在漏斗颈下加一只小试管,试管内加满稀盐酸后,漏斗被封,多余的盐酸流出与大理石反应,制取二氧化碳.
故答案为:
本题解析:
本题难度:一般