微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
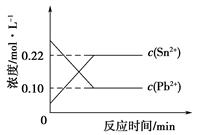
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0
D.25℃时,该反应的平衡常数K=2.2
参考答案:D
本题解析:根据图示知,往平衡体系中加入金属铅后,c(Pb2+)减小,故A错误;往平衡体系中加入少量Sn(NO3)2固体后,c(Sn2+)增大,平衡向左移动,故c(Pb2+)增大,故B错误;升高温度,平衡体系中c(Pb2+)增大,说明平衡向左移动,即逆反应方向为吸热反应,故该反应⊿H<0,故C错误。
本题难度:一般
2、实验题 (12分)测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I-反应成
I3-,并在溶液中建立如下平衡:I2 +I- I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol·L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用_________做指示剂,滴定终点的现象是________。
(2)下列对该同学设计方案的分析,正确的是__________(填字母)。
A.方案可行。能准确测定溶液中的c(I2)?
B.不可行。因为I-能与Na2S2O3发生反应?
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
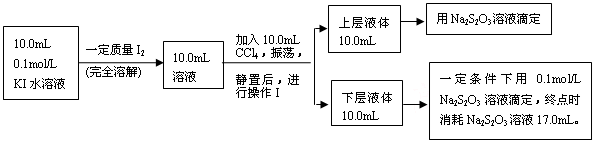
已知:①I-和I3-不溶于CCl4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即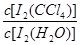 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是______(填名称)。
试指出该操作中应注意的事项为?。(任写一条)
(4)下层液体中碘单质的物质的量浓度是__________。
(5)实验测得上层溶液中c(I3-)="0.049" mol·L-1,结合上述有关数据,计算室温条件下反应I2+I- I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
参考答案:(1)淀粉(1分)溶液由蓝色变无色,且半分钟后颜色不再改变(2分)
(2)C(2分)?
(3)分液漏斗(1分),分液时上层液体应从上口出,下层液体应从下口出(或分液漏斗末端应紧靠烧杯内壁或打开上口活塞,使分液漏斗内外压强相等便于液体流下等。(2分),其他合理答案也给分);
(4)0.085mol/L(2分)
(5)961(2分)?(共12分)
本题解析:(1)碘单质遇淀粉,溶液呈特殊的蓝色,即可用淀粉做指示剂。滴定终点碘被反应掉,现象是:溶液由蓝色变无色
(2)由于碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2 +I- I3-。随着碘单质浓度的减小,平衡向左移动,所以上述的方案只能测得溶液中c(I2 )与c(I3-)之和,方案不可行。
I3-。随着碘单质浓度的减小,平衡向左移动,所以上述的方案只能测得溶液中c(I2 )与c(I3-)之和,方案不可行。
(3)萃取后溶液分为有机层与水溶液层,操作I就是分液操作:用分液漏斗将其分离
分液过程的注意事项包括:一是上下层液体不能混合,分液时上层液体应从上口出,下层液体应从下口出;二是分液漏斗末端应紧靠烧杯内壁;三是打开上口活塞,使分液漏斗内外压强相等便于液体流下等
(4)根据:I2+2Na2S2O3=2NaI+Na2S4O6),则
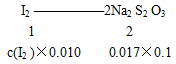
解得下层液体中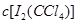 = 0.085mol/L
= 0.085mol/L
(5) 由Kd=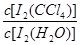 =85求得上层溶液中
=85求得上层溶液中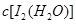 = 0.085/85=0.001mol/L
= 0.085/85=0.001mol/L
又原溶液中c(I-)=0.1mol·L-1,所得到的上层溶液中c(I3-)="0.049" mol·L-1
由反应I2 +I- I3-可知,上层溶液中c(I-)=(0.1—0.049)mol·L-1=0.051mol·L-1
I3-可知,上层溶液中c(I-)=(0.1—0.049)mol·L-1=0.051mol·L-1
所以,在此温度下反应I2 +I- I3平衡常数K=
I3平衡常数K=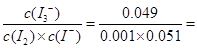 961
961
本题难度:简单
3、计算题 (10分).已知一氧化碳与水蒸气的反应为CO+H2O CO2+H2;在827℃时的平衡常数是100,如果反应开始时,一氧化碳和水蒸气的浓度都是0.011mol/L,计算:一氧化碳在此反应条件下的平衡转化率。
CO2+H2;在827℃时的平衡常数是100,如果反应开始时,一氧化碳和水蒸气的浓度都是0.011mol/L,计算:一氧化碳在此反应条件下的平衡转化率。
参考答案:9.09%
本题解析:? CO?+ ?H2O?=? CO2?+? H2
起始浓度(mol/l)? 0.011? 0.011? 0? 0
转化浓度(mol/l)? x? x? x? x
平衡浓度(mol/l)0.011-x ?0.011-x?x?x
因为
所以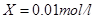
因此转化率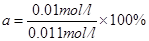 =9.09%
=9.09%
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。
本题难度:一般
4、填空题 联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)==N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应
2NO2(g)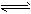 N2O4(g)达到平衡。 其他条件不变时,下列措施能提高NO2转化率的是__________(填序号)
N2O4(g)达到平衡。 其他条件不变时,下列措施能提高NO2转化率的是__________(填序号)
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=____________kJ·mol-1
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2NO2(g)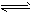 N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2H4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
参考答案:(1)BC
(2)-1224.96 (3)K=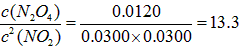
(4)由(3)可知,在17℃、1.01×105Pa达到平衡时,1.00L混合气体中
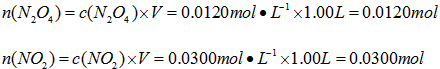
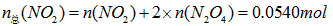
由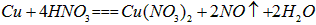 可得
可得
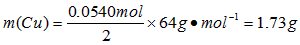
本题解析:
本题难度:困难
5、填空题 如图所示,某温度下,物质的量分别是 1.2mol的气体X和物质的量为1.0mol的气体Y,在2L密闭容器中反应生成气体Z,反应5min 后测得n(X)?=0.4mol,n(Y)=0.2mol,生成的n(Z)=1.6mol,则该反应的反应物为____________该反应的化学方程式可表示为_____________,反应在10分钟内的化学反应速率用Z来表示则V(Z)=___________。
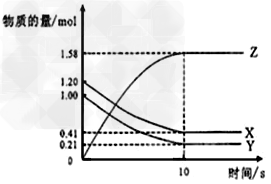
参考答案:X?和Y?;X?+?Y 2Z;0.079?mol?/(L·min)
2Z;0.079?mol?/(L·min)
本题解析:
本题难度:一般