| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《原电池原理》高频考点预测(2017年最新版)(二)
(2)上图装置中盛有100 mL 0.1 mol·L-1 AgNO3溶液,当氢氧燃料电池中消耗氢气112 mL(标准状况下)时,此时图中装置中溶液的pH=?(溶液体积变化忽略不计)。 Ⅱ.已知甲醇的燃烧热ΔH为-726.5 kJ·mol-1,在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为?,正极的反应式为?。 理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为?(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。 参考答案:Ⅰ.(1)C、D? (2)1 本题解析:Ⅰ.(1)C项反应条件不是点燃,C项错;随着燃料电池的不断反应,水越来越多,KOH溶液浓度逐渐减小,pH逐渐减小,故D错。 本题难度:一般 3、填空题 (10分)下图中电极a、b分别为Ag电极和P 参考答案:(10分)(1)正;(2分)(2)4OH――4e― 本题解析:略 本题难度:一般 4、选择题 下列关于铜锌原电池(装置如下图)的说法,正确的是 参考答案:C 本题解析: 本题难度:一般 5、选择题 如图所示,下列判断中正确的是( ) |
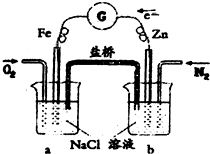
参考答案:A.烧杯a中氧气得电子生成氢氧根离子,导致氢氧根离子浓度增大,则溶液H+减小,故A错误;
B.烧杯b中锌失电子发生氧化反应,故B正确;
C.烧杯a中发生的反应为:O2+2H2O+4e-=4OH-,故C错误;
D.烧杯b中发生的反应为:Zn-2e-=Zn2+,故D错误;
故选B.
本题解析:
本题难度:简单
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点大全《反应速率与.. | ||