微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将铜粉放入稀硫酸中,加热无明显现象发生。但加入某盐后,发现铜粉质量逐渐减少,该盐可能是
A.Fe2(SO4)3
B.ZnSO4
C.KNO3
D.NaCl
参考答案:AC
本题解析:Fe2(SO4)3会与铜粉反应生成硫酸亚铁和硫酸铜。加入KNO3后,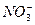 在H+条件下具有强氧化性,能把铜氧化为硝酸铜。
在H+条件下具有强氧化性,能把铜氧化为硝酸铜。
本题难度:简单
2、填空题 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

回答下列问题:
(1)焙烧硫铁矿的主要方程式为?。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、??。
(3)通氯气氧化后时,发生的主要反应的离子方程式为??;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式)?。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:?。
(5)如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为?。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K=??; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率?。
2SO3(g),该反应的平衡常数表达式为K=??; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率?。
①V2O5作崔化剂?②通入过量O2?③SO2、O2进行二次氧化?④通入过量SO2
参考答案:(1)4 FeS2 + 11 O2 2 Fe2O3 +? 8SO2(2分)
2 Fe2O3 +? 8SO2(2分)
(2)抑制Fe3+水解(2分)
(3)Cl2+Fe2+=2Cl-+Fe3+ (2分) Cl2?HCl(2分)
(4)取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。(2分)
(5)Fe2O3(2分)
(6)k=c2(SO3)/c(O2)·c2(SO2) (2分)?②③(2分)
本题解析:(1)焙烧硫铁矿是硫酸工业中制取二氧化硫气体的重要步骤,发生的氧化还原反应配平比较困难,利用电子得失守恒配平得: 4 FeS2 + 11 O2 2 Fe2O3 +? 8SO2(2分)
2 Fe2O3 +? 8SO2(2分)
(2)酸溶焙烧产物不仅是提高浸出率,还可以抑制溶解得到的Fe3+水解。
(3)因为最终要得到的产品是氯化铁晶体,所以可能焙烧不完全,仍有部分亚铁离子,所以加入氧化剂氯气氧化除去,发生的反应为Cl2+Fe2+=2Cl-+Fe3+ ,该过程可能有氯气溶于水产生挥发性的HCl以及过量的Cl2,所以可以用碱吸收。
(4)检验是否全部转化为Fe3+ ,就是检验Fe2+ 的存在,所以检验Fe2+ 可以使用高锰酸钾试剂,所以操作为:取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。
(5)氯化铁晶体(FeCl3·6H2O)含有水分,所以加热灼烧过程中,FeCl3 会发生水解并最终得到稳定的氧化物Fe2O3 。
(6)根据方程式可以写出平衡常数表达式为k=c2(SO3)/c(O2)·c2(SO2);要提高SO2 的转化率,则需要使平衡正向移动或SO2 二次利用,所以可行的是②、③。
本题难度:困难
3、选择题 将质量为m g的铁粉与铜粉的混合物,溶于100mL 4mol·L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为
A.5.52g
B.(m+6.8)g
C.(m+2.55)g
D.(m+12.0)g
参考答案:C
本题解析:所得还原产物为0.05mol NO,所以转移的电子数就是0.15mol,铁粉与铜粉共失去0.15mol电子,带0.15mol的正电荷,所以要结合0.15mol氢氧根离子,沉淀质量为铁粉与铜粉的质量mg+0.15mol氢氧根离子,即为(m+2.55)g,故选C。
本题难度:简单
4、简答题 铝、铁两种金属的单质及其化合物在生产、生活中有着广泛的应用.请回答:
(1)两种金属对应的氧化物中,具有两性的物质是(填化学式)______,其与NaOH溶液反应生成的盐是(填化学式)______.
(2)向FeCl3溶液中滴入KSCN溶液,可以观察到的现象是(填序号)______.
①产生红色沉淀②形成红色溶液
(3)将氢氧化亚铁浊液置于空气中,观察到白色沉淀迅速变为灰绿色,最后变为红褐色,写出反应的化学方程式______.
参考答案:(1)铝、铁两种金属的单质对应的氧化物中,具有两性的物质是氧化铝Al2O3,具有两性能和强酸强碱反应,与氢氧化钠溶液反应生成的盐是偏铝酸钠NaAlO2;
故答案为:Al2O3;NaAlO2;
(2)向FeCl3溶液中滴入KSCN溶液,可以观察到的现象是形成红色溶液,反应离子方程式为Fe3++3SCN-=Fe(SCN)3;
故答案为:②;
(3)将氢氧化亚铁浊液置于空气中,观察到白色沉淀迅速变为灰绿色,最后变为红褐色,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4 Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
本题解析:
本题难度:一般
5、填空题 某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出
了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为_______________________________________
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。
正极反应式:_______________________。
负极反应式:_______________________。
方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):______________________,用离子方程式表示其反应原理:________________________________。
参考答案:方案Ⅰ:Fe+2H+=Fe2++H2↑
方案Ⅱ:
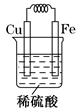
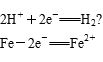
方案Ⅲ:将铁片置于CuSO4溶液,若铁棒表面覆盖一层铜,说明Fe比Cu活动性强
Fe+Cu2+=Fe2++Cu(合理即可)
本题解析:方案Ⅰ:铁与酸反应而铜与酸不反应。Fe+2H+=Fe2++H2↑
方案Ⅱ:设计原电池时以铁、铜为电极,电解质溶液应能与电极反应,实验现象应比较明显。
方案Ⅲ:设计简单实验时注意原理与方案Ⅰ及方案Ⅱ的原理不同,且现象明显,操作简单。
本题难度:一般