微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)某化学兴趣小组利用实验室提供的下列试剂:铁粉、0.1mol·L-1FeCl3溶液、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+?、Fe3+的氧化性、还原性,并对实验结果加于应用。
(1)兴趣小组通过对Fe2+、Fe3+ 的价态分析,对Fe2+、Fe3+ 的氧化性、还原性提出了如下3种假设:
假设一:Fe2+具有?性;
假设二:Fe2+具有?性;
假设三:Fe3+具有?性;
(2)设计实验方案,进行实验并描述实验现象,完成下列表格。
探究内容
| 实验方案
| ?实验现象
| 写出下列离子方程式
|
探究Fe2+具有还原性
| 取少量0.1mol·L-1FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量?
| 溶液先不变红,
后变为血红色
| ①Fe2+发生的反应:
|
探究Fe3+具有氧化性
| 取少量0.1mol·L-1FeCl3溶液,加入足量?后,再往溶液中加入少量KSCN溶液
| 溶液不变为血红色
| ②Fe3+发生的反应:
|
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了一个反应事实:FeCl2 + Zn ="=" ZnCl2 + Fe
该反应的离子方程式为:?。
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是:?。
参考答案:(15分)假设一:Fe2+具有?还原?性;
假设二:Fe2+具有?氧化?性;
假设三:Fe3+具有?氧化?性;
(2)
探究内容
实验方案
?实验现象
写出下列离子方程式
探究Fe2+具有还原性
再往溶液中加入少量?新制氯水?
溶液先不变红,后变为血红色
①?Fe2+发生的反应:
? 2Fe2++Cl2=2Fe3++ 2Cl-?
探究Fe3+具有氧化性
加入足量
?铁粉?
溶液不变为血红色
②Fe3+发生的反应:
? 2 Fe3++ Fe= 3Fe2+?
(3)该反应的离子方程式为:? Zn+Fe2+= Zn2++ Fe?。
(4)反应的离子方程式是:? 2 Fe3++Cu= 2Fe2+ +Cu2+??。
本题解析:略
本题难度:一般
2、选择题 下列说法正确的是
[? ]
A.钠保存在煤油里的原因之一是它极易与氧气反应
B.铝在空气中很容易燃烧
C.镁表面的氧化膜疏松,不能保护内层金属
D.铁锈的主要成分是Fe3O4
参考答案:A
本题解析:
本题难度:简单
3、填空题 (12分)A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如下所示转化关系。
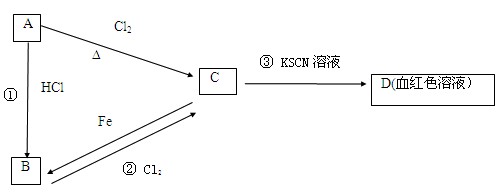
试回答下列问题:
(1)A是?,C是?。
(2)C的溶液与NaOH溶液混合后的现象是??。
(3)反应①的反应类型是?反应(选填“化合”“分解”“置换”“复分解”)。
参考答案:(12分)
(1)A是? Fe?,C是? FeCl3?。
(2)?产生红褐色沉淀?。
(3)?置换?。
本题解析:略
本题难度:一般
4、填空题 (12分)利用染化厂的废料铁泥(主要成分是Fe2O3、FeO和铁)制备可用于隐形飞机涂层的纳米四氧化三铁的生产流程为:
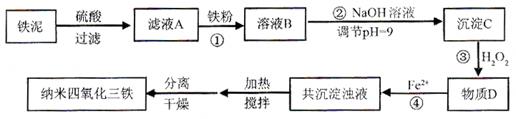
请回答:
(1)过程①主要反应的离子方程式为?。
(2)已知氢氧化亚铁的Ksp=4.87×10-17,氢氧化铁的Ksp=2.6×10-39。
当溶液中某离子浓度不高于1×10-5 mol·L-1时,可以认为该离子已经完全沉淀。通过计算所得数据说明过程②调节pH=9的原因是?。
(3)物质D的主要产物中铁、氢、氧三种元素的质量比为56∶1∶32,则过程③主要反应的化学方程式为?。
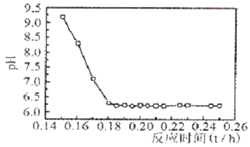
(4)已知Fe2+在弱碱性溶液中还原性较强,图11是研究过程④的实验所得,则该反应所需的时间控制在?小时左右,较为适宜。
(5)某工厂处理废铁泥(测得铁元素含量为16.8 %)的能力为10吨/小时,生产纳米四氧化三铁的产量为4.64吨/小时。如不考虑过程④以后生产中Fe2+的氧化,则该工厂每小时消耗铁粉的质量为?千克。
参考答案:(1)2Fe3+ + Fe = 3Fe2+?(2分)?(2)当pH=9时,c(Fe2+)=4.87×10-7mol·L—1 (2分)
(3)2Fe(OH)2 +H2O2=2FeO(OH)+2H2O(物质D写成Fe(OH)O或FeHO2、FeO2H均可以)(2分)?(4)0.16(2分)?(5)560(4分)
本题解析:(1)滤液A中含有铁离子,所以方程式为2Fe3+ + Fe = 3Fe2+。
(2)根据氢氧化亚铁的溶度积常数可知,当pH=9时,c(Fe2+)=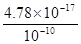 4.87×10-7mol·L—1,此时已经完全沉淀。
4.87×10-7mol·L—1,此时已经完全沉淀。
(3)铁、氢、氧三种元素的质量比为56∶1∶32,则原子个数之比时1︰1︰2,即化学式为FeO(OH),所以反应式是2Fe(OH)2 +H2O2=2FeO(OH)+2H2O。
(4)根据图11可知,当溶液显弱碱性时,对应的时间大约是0.16h。
(5)4.64吨四氧化三铁中铁的质量是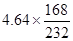 =3.36吨,其中相当于氧化铁的质量是2.24吨,另外的铁来自于亚铁离子。10吨铁泥中铁的质量是16.8 %×10=1.68吨,所以需要铁粉的质量是2.24吨-1.68吨=0.56吨。
=3.36吨,其中相当于氧化铁的质量是2.24吨,另外的铁来自于亚铁离子。10吨铁泥中铁的质量是16.8 %×10=1.68吨,所以需要铁粉的质量是2.24吨-1.68吨=0.56吨。
本题难度:一般
5、选择题 根据下列框图分析,下列说法正确的是( )

A.E3+的氧化性比M2+的氧化性弱
B.在反应①中硫酸既表现了酸性、又表现了氧化性
C.反应④的离子方程式可表示为:3SCN-+E3+ E(SCN)3↓
E(SCN)3↓
D.在③反应中若不加稀硫酸可能看到红褐色沉淀
参考答案:D
本题解析:M是红色金属,则可以确定是金属铜,在H2O2作用下与H2SO4反应生成CuSO4,Y遇到KSCN出现红色,Y中有Fe3+,则金属E是铁,X是FeSO4,经③步反应氧化为Fe2(SO4)3,与氨水反应得到红褐色的Fe(OH)3。Fe3+的氧化性比Cu2+的氧化性强,A错;在反应①中硫酸只表现了酸性,H2O2表现了氧化性,B错;SCN-与Fe3+反应生成的产物是可溶于水的配离子,C错;反应③为:2Fe2++H2O2+2H+ 2Fe3++2H2O,可见反应过程消耗H+,pH增大,有可能会生成红褐色的Fe(OH)3沉淀,D正确。
2Fe3++2H2O,可见反应过程消耗H+,pH增大,有可能会生成红褐色的Fe(OH)3沉淀,D正确。
本题难度:一般