微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定体积的18 mol/L的硫酸中加入过量铜片,加热,被还原的硫酸为0.9 mol,则浓硫酸的实际体积为
A.等于50 mL
B.大于50 mL
C.等于100 mL
D.大于100 mL
参考答案:D
本题解析:由于铜和浓硫酸的反应过程中,随着反应的进行,硫酸的浓度逐渐降低,而稀硫酸与铜不反应,所以根据反应式Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑可知,如果被还原的硫酸为0.9 mol,则实际参加反应的硫酸的物质的量大于1.8mol,因此浓硫酸的实际体积大于100ml,答案选D。
CuSO4+2H2O+SO2↑可知,如果被还原的硫酸为0.9 mol,则实际参加反应的硫酸的物质的量大于1.8mol,因此浓硫酸的实际体积大于100ml,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,贴近高考。该题的关键是明确稀硫酸与浓硫酸的性质差异,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用知识解决实际问题的能力。
本题难度:简单
2、选择题 由FeO、Fe2O3、Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,则这种混合物中FeO、Fe2O3、Fe3O4的物质的量之比可能为( )
A.1:2:1
B.2:1:1
C.1:1:1
D.1:1:38
参考答案:CD
本题解析:
本题难度:简单
3、填空题 mg 铁粉与一定量的HNO3在一定条件下充分反应,将生成的气体与标准状况nL氧气混合,恰好能被水完全吸收,m和n的关系是什么?
参考答案:O.2m≤n≤O.3m
本题解析: 此题看起来,涉及的化学反应相当复杂,因HNO3的浓度和用量不同,生成Fe(NO3)3还是Fe(NO3)2不能确定,HNO3的还原产物是NO还是NO2也不能确定。所以消耗的氧气也无从下手求出.但是从始态和终态来看,HNO3的还原产物与氧气混合后,最终还是生成HNO3,这样消耗的氧气相当于把mg铁粉氧化成+2价或+3价化合物,用极端思考法很容易求出。
此题看起来,涉及的化学反应相当复杂,因HNO3的浓度和用量不同,生成Fe(NO3)3还是Fe(NO3)2不能确定,HNO3的还原产物是NO还是NO2也不能确定。所以消耗的氧气也无从下手求出.但是从始态和终态来看,HNO3的还原产物与氧气混合后,最终还是生成HNO3,这样消耗的氧气相当于把mg铁粉氧化成+2价或+3价化合物,用极端思考法很容易求出。

 假设HNO3为稀的,铁与HNO3反应后的价态是+2,
假设HNO3为稀的,铁与HNO3反应后的价态是+2,
 ?则有:? 3 Fe +8 HNO3=" 3" Fe(NO3)2 + 2 NO↑+ 4 H2O? (1)
?则有:? 3 Fe +8 HNO3=" 3" Fe(NO3)2 + 2 NO↑+ 4 H2O? (1)
 ? 4NO +3O2 +2H2O=4HNO3?(2)
? 4NO +3O2 +2H2O=4HNO3?(2)
 (1)×2 +(2)得:2Fe + O2 +4HNO3= 2Fe(NO3)2 +2H2O
(1)×2 +(2)得:2Fe + O2 +4HNO3= 2Fe(NO3)2 +2H2O
 ?可改写为 : 2Fe + O2 +4HNO3 ="?" 2FeO + 4HNO3
?可改写为 : 2Fe + O2 +4HNO3 ="?" 2FeO + 4HNO3
 ?即:? 2Fe + O2 =2FeO
?即:? 2Fe + O2 =2FeO
 ?同理可得 :? 4Fe +3O2=2Fe2O3?问题便得以解决
?同理可得 :? 4Fe +3O2=2Fe2O3?问题便得以解决
 即 :当铁被氧化为+2价时,由电子得失守衡得:
即 :当铁被氧化为+2价时,由电子得失守衡得:
 ? m/56×2=n/22.4×4? n=O.2m
? m/56×2=n/22.4×4? n=O.2m
 当铁被氧化为=+3价时,由电子得失守衡得:
当铁被氧化为=+3价时,由电子得失守衡得:
 ? m/56×3=n/22.4×4? n="O.3m?"
? m/56×3=n/22.4×4? n="O.3m?"
 则m与n的关系是:O.2m≤n≤O.3m
则m与n的关系是:O.2m≤n≤O.3m
本题难度:一般
4、选择题 制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油;②溶解FeSO4配成溶液;③把蒸馏水加热煮沸,并密封冷却;④加入少量铁屑;⑤向FeSO4溶液中滴加足量氨水;⑥把盛有氨水的胶头滴管伸入FeSO4溶液中后再挤出氨水。进行操作的正确顺序是
A.③②⑤④
B.③②④①⑥
C.③②④⑥
D.②④①⑥
参考答案:B
本题解析:对于Fe(OH)2的制备,应注意排除装置内的所有空气,同时也应排除溶液中溶有的少量氧气,防止生成的Fe(OH)2被氧化,因此正确的顺序为③②④①⑥,故答案为B。2的制备
点评:此题考查Fe(OH)2的制备,属于基础题,只要掌握课本知识即可得出答案。
本题难度:一般
5、填空题 1 g CuO和木炭粉的混合物,在隔绝空气的条件下加热一段时间并冷却,质量变为 x g,
若反应中只产生CO2。
(1)实验中有?g ?CuO被还原,?(2)x的取值范围是?。
参考答案:(1)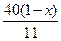 ?,(2)
?,(2)
本题解析:略
本题难度:简单