微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一固定容积的密闭容器中,保持一定温度,在一定条件下发生以下反应:
2A(g)+B(g) 3C(g)。
3C(g)。
已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
(1)达到平衡时,C在反应混合气中的体积分数是______(用含a的代数式表示)。
(2)在相同的实验条件下,若在同一容器中改为加入2 mol A 和4 mol B,达到平衡后,C的物质的量为______mol(用含a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比________(填“增大”、“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和5 mol B,若要求平衡后C在反应混合气中的体积分数仍与原平衡相同,则还应加入________ mol C。
参考答案:(1)a/3 (2)2a 不变 (3)1
本题解析:(1)根据方程式可知,反应前后体积是不变的,所以达到平衡时,C在反应混合气中的体积分数是 。
。
(2)由于反应前后体积是不变,所以在同一容器中改为加入2 mol A 和4 mol B时平衡是等效的,所以达到平衡后,C的物质的量为2amol,此时C在反应混合气中的体积分数与原平衡相比不变。
(3)由于反应前后体积是不变,所以要满足平衡等效,则最初的投料比是相同的。设C的物质的量为xmol,则转化成A和B的物质的量分别为2X/3和X/3,则有(2+2x/3):(5+x/3)=1:2,解得x=1mol。
点评:该题是中等难度的试题,试题注重基础,侧重能力的考查和训练。该题的关键是明确等效平衡的判断依据,然后结合题意灵活运用、分析判断即可,有利于培养学生的逻辑思维能力和抽象思维能力。
本题难度:一般
2、选择题 对气体反应:mA+nB eC 温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是(?)
eC 温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是(?)
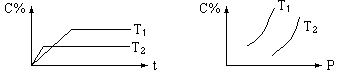
A.m+n>e
B.m+n<e
C.正反应是吸热反应
D.逆反应是放热反应
参考答案:A
本题解析:根据图像可知,温度为T2的曲线首先达到平衡状态,因此温度是T2大于T1。温度高C的百分含量低,所以升高温度平衡向逆反应方向进行,因此正反应是放热反应,则逆反应就是吸热反应。压强越大C的百分含量越大,说明增大压强,平衡向正反应方向进行,因此正反应是体积减小的,即 m+n>e ,所以正确的答案选A。
本题难度:一般
3、选择题 PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,10 min时达到平衡:PCl3(g) + Cl2(g) PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是
?
| PCl3(g)
| Cl2(g)
| PCl5(g)
|
初始浓度(mol/L)
| 2.0
| 1.0
| 0
|
平衡浓度(mol/L)
| c1
| c2
| 0.4
|
?
A.10 min内,v(Cl2) =" 0.04" mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.若升高温度(T1<T2)时,该反应平衡常数减小,则平衡时PCl3的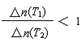
D.平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
参考答案:C
本题解析:? PCl3(g)? +? Cl2(g)? ?PCl5(g)
?PCl5(g)
起始浓度:? 2.0? 1.0? 0
转化:?0.4? 0.4? 0.4
平衡浓度:? 1.6? 0.6? 0.4
A、10 min内,v(Cl2) =" 0.04" mol/(L·min),正确;B、当容器中Cl2为1.2 mol时,此时Cl2浓度为0.6 mol/L。反应达到平衡,正确;C、若升高温度(T1<T2)时,该反应平衡常数减小,表明该反应正向为放热反应,高温时PCl3的浓度改变量小,则平衡时PCl3的
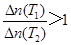 ,正确;D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L,正确。
,正确;D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L,正确。
本题难度:一般
4、填空题 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
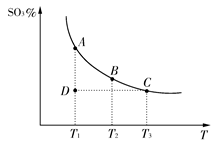
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)  2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)2SO2(g)+O2(g)  2SO3(g)的ΔH________0(填“>”或“<”);若在恒温;恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不”);
2SO3(g)的ΔH________0(填“>”或“<”);若在恒温;恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不”);
(2)若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1________K2;若反应进行到状态D时,v正________v逆(填“>”“<”或“=”);
参考答案:(1)< 向左 (2)> >
本题解析:(1)从图像来看,SO3的含量随着温度的升高而降低,说明反应逆向移动,故该反应为放热反应;恒温、恒容条件下,充入氦气,容器容积增大,对原反应混合物来说相当于减小压强,平衡逆向移动。(2)因该反应是放热反应,平衡常数随着温度的升高而降低;D点要达到相应温度下的平衡状态,SO3的含量应继续增大,故正反应速率大于逆反应速率。
本题难度:一般
5、选择题 反应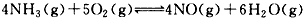 在2L 的密闭容器中进行,1 min后,NH3减少了
在2L 的密闭容器中进行,1 min后,NH3减少了
0.12 mol,则平均每秒的浓度变化正确的是
[? ]
A.NO:0. 001 mol/L
B.H2O:0. 002 mol/L
C.NH3:0. 002 mol/L
D.O2:0. 001 25 mol/L
参考答案:AD
本题解析:
本题难度:简单