微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在500℃时,发生可逆反应2SO2(g)+O2(g)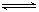 2SO3(g);ΔH<0。向甲容器中充入1molSO2和0.5molO2,向相同容积的乙容器中充入1molSO3。若甲容器保持容积不变,乙容器保持压强不变,分别达平衡,下列说法不正确的是:
2SO3(g);ΔH<0。向甲容器中充入1molSO2和0.5molO2,向相同容积的乙容器中充入1molSO3。若甲容器保持容积不变,乙容器保持压强不变,分别达平衡,下列说法不正确的是:
A.平衡时,容器内的压强:甲>乙
B.反应达平衡时所需时间:甲<乙
C.平衡时,氧气的浓度:甲<乙
D.平衡时,容器内SO3的体积百分数:甲>乙
参考答案:C
本题解析:
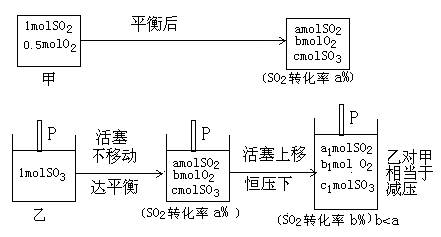
起始时,甲、乙两容器体积相同,在同温下,若保持乙容器体积不变,则两容器达到同一平衡状态,即等效平衡。而实际上乙是恒压容器,加入1mol SO3反应向逆向进行,混合气体的总物质的量增大,活塞P上移,容器的体积扩大。这一过程乙对甲相当于减压,平衡逆移。因此,达平衡时,容器内压强:甲>乙;A正确。达平衡的时间乙容器长∴甲<乙B正确。平衡时氧气的浓度:甲>乙,虽然平衡逆移,O2的物质的量增多,但容器体积的增大为主要因素,即只能“减弱”这种改变,不能“消除”(平衡移动原理)。C错;平衡时,容器内SO3的体积百分数:甲>乙(因SO2的转化率减小);D正确。
本题难度:一般
2、选择题 在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g)测得开始时,SO2、O2和SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
2SO3(g)测得开始时,SO2、O2和SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
[? ]
A.O2为0.15mol·L-1
B.SO2为0.25mol·L-1
C.SO3为0.4mol·L-1
D.O2、SO3的浓度相等
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列说法中正确的是
A.从平衡常数的大小可以推断任意反应进行的程度
B.对同一反应,K值越大,反应的转化率越大
C.K值越大,反应的转化率越小
D.温度越高,K值越大
参考答案:B
本题解析:平衡常数是指当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物能浓度的幂之积的比值。平衡常数只与温度有关,升高温度平衡常数可能增大,也可能减小。平衡常数越大,说明平衡体系中生成物所占的比例越大,它的正向反应进行的程度越大,即该反应进行的越完全,反应物转化率越大。所以正确的答案是B。
本题难度:一般
4、选择题 已知一定温度下合成氨反应:N2 +3 H2 2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是
2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是
A.Q2 =" 2" Q1
B.Q1 < 0.5 Q2
C.Q1 < Q2 < 184.8 kJ
D.Q1 = Q2 < 92.4 kJ
参考答案:AC
本题解析:由题可知,恒温恒压,第二次也达到等效平衡,所以A选项Q2 =" 2" Q1 ?正确,第二次为第一次的2倍,所以热量也为2倍。又可知可逆反应不可能完全反应,所以Q2 < 2*92.4=184.8kJ,所以C选项也正确。
本题难度:一般
5、选择题 进行如下实验,在A锥形瓶中放入10g绿豆大小的碳酸钙,在B锥形瓶中放入5g粉末状的碳酸钙,分别加入50mL 1mol/L盐酸,下图中能正确表示实验结果的是(?)
(注:x一时间、y-锥形瓶中碳酸钙减少的质量)
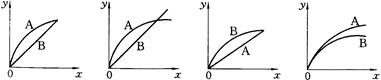
A? B? C?D
参考答案:C
本题解析:盐酸不足,最终产生CO2的量相同,溶解CaCO3的质量也相等,但粉末状的CaCO3与盐酸接触的表面积大,开始的反应速率快,故C选项符合题意。
本题难度:一般