微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:
X2?(g+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
容器编号
| 起始时各物质物质的量/mol
| 达平衡时体系能量的变化
|
X2
| Y2
| XY3
|
①
| 1
| 3
| 0
| 放热46.3 kJ
|
②
| 0.8
| 2.4
| 0.4
| Q(Q>0)
|
?
下列叙述不正确的是
A.容器①中达到平衡时,Y2的转化率为50%
B.Q="27.78" kJ
C.若容器①体积改为1.0 L.则达平衡时放出的热量大于46.3 kJ
D.容器①、②中反应的平衡常数相等,K=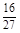
参考答案:D
本题解析:由X2(g+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1可知3molY2完全反应非常热量为92.6 kJ。发生反应的物质越多,放出的热量就越多。①中达到平衡时,反应放热46.3 kJ。所以Y2的转化率为(46.3 kJ÷92.6 kJ )×100%=50%.正确。B.②?假如0.4mol的XY3不是起始加入的,而是由X2、Y2反应生成的,则相当于起始投入量为X2="1mol;" Y2=3mol。与①?相同。则为等效起始状态。平衡状态相同。根据A的分析可知平衡时Y2=1.5mol.转化量为2.4-1.5=0.9mol.所以放出热量Q=(0.9÷3)×92.6 kJ="27.78" kJ。正确。C.若容器①体积改为1.0 L.则相当于给容器增大压强,由于该反应的正反应是气体体积减小的反应。所以根据平衡移动原理:增大压强,化学平衡向气体体积减小的方向(即正反应方向移动)。所以达平衡时放出的热量大于46.3 kJ。正确。D.容器①、②中反应是在相同温度下的同一个平衡状态,所以平衡常数相等,
2XY3(g) ΔH=-92.6 kJ·mol-1可知3molY2完全反应非常热量为92.6 kJ。发生反应的物质越多,放出的热量就越多。①中达到平衡时,反应放热46.3 kJ。所以Y2的转化率为(46.3 kJ÷92.6 kJ )×100%=50%.正确。B.②?假如0.4mol的XY3不是起始加入的,而是由X2、Y2反应生成的,则相当于起始投入量为X2="1mol;" Y2=3mol。与①?相同。则为等效起始状态。平衡状态相同。根据A的分析可知平衡时Y2=1.5mol.转化量为2.4-1.5=0.9mol.所以放出热量Q=(0.9÷3)×92.6 kJ="27.78" kJ。正确。C.若容器①体积改为1.0 L.则相当于给容器增大压强,由于该反应的正反应是气体体积减小的反应。所以根据平衡移动原理:增大压强,化学平衡向气体体积减小的方向(即正反应方向移动)。所以达平衡时放出的热量大于46.3 kJ。正确。D.容器①、②中反应是在相同温度下的同一个平衡状态,所以平衡常数相等,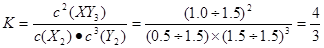 。错误。
。错误。
本题难度:一般
2、选择题 一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
?
| 甲
| 乙
| 丙
| 丁
|
密闭容器体积/L
| 2
| 2
| 2
| 1
|
起始物质的量
| n(SO2)/mol
| 0.4
| 0.8
| 0.8
| 0.4
|
n(O2)/mol
| 0.24
| 0.24
| 0.48
| 0.24
|
SO2的平衡转化率/%
| 80
| α1
| α2
| α3
|
?
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.该温度下,甲和乙中反应的平衡常数K均为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙>甲=丁
参考答案:B
本题解析:A、温度一定,平衡常数不变,错误;B、甲中平衡常数K= 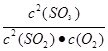 =
=  =400,正确;C、乙和丙中二氧化硫起始量相同,但丙中氧气物质的量大于乙中氧气物质的量,所以α1<α2,丙和丁中二氧化硫和氧气起始浓度相同,平衡等效,二氧化硫转化率相等,错误;D、丙和丁平衡等效,三氧化硫浓度相同;丙中二氧化硫和氧气起始浓度是甲中二氧化硫和氧气起始浓度的2倍,浓度加倍等效于增大压强,所以丙中三氧化硫浓度大于甲中三氧化硫浓度,错误。
=400,正确;C、乙和丙中二氧化硫起始量相同,但丙中氧气物质的量大于乙中氧气物质的量,所以α1<α2,丙和丁中二氧化硫和氧气起始浓度相同,平衡等效,二氧化硫转化率相等,错误;D、丙和丁平衡等效,三氧化硫浓度相同;丙中二氧化硫和氧气起始浓度是甲中二氧化硫和氧气起始浓度的2倍,浓度加倍等效于增大压强,所以丙中三氧化硫浓度大于甲中三氧化硫浓度,错误。
本题难度:一般
3、选择题 反应A(g)+3B(g)═2C(g)+2D(g)在四种不同情况下的反应速率分别为:
①v(A)=0.45mol?L-1?min-1②v(B)=0.6mol?L-1?s-1
③v(C)=0.4mol?L-1?s-1④v(D)=0.45mol?L-1?s-1
下列有关反应速率的比较中正确的是( )
A.④>③=②>①
B.③=②<④<①
C.①>②>③>④
D.④>③>②>①
参考答案:A
本题解析:
本题难度:简单
4、选择题 已知H2(g)+I2(g) 2HI(g);△H<0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入0.1mol H2和0.2molI2,相同温度下分别达到平衡。下列说法不正确的是
2HI(g);△H<0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入0.1mol H2和0.2molI2,相同温度下分别达到平衡。下列说法不正确的是
A.乙中反应速率比甲中反应速率快
B.平衡时甲、乙两容器中混合物的总物质的量之比为2︰3
C.若平衡时甲中H2的转化率为40%,则乙中H2的转化率大于40%
D.平衡后,向乙中再加入0.1mol H2,建立新的平衡时,甲和乙中H2的百分含量不相同
参考答案:D
本题解析:本题考查化学平衡的影响因素及有关计算。乙中I2浓度比甲中大,反应更快,A正确;H2(g)+I2(g) 2HI(g)是等体积反应,平衡前后的物质的量不变,故平衡时甲、乙两容器中混合物的总物质的量之比为2︰3,B正确;乙中I2浓度比甲中大,故乙中H2的转化率大于40%,C正确;平衡后,向乙中再加入0.1mol H2,建立新的平衡与甲中平衡为等效平衡,甲和乙中H2的百分含量相同,D不正确。
2HI(g)是等体积反应,平衡前后的物质的量不变,故平衡时甲、乙两容器中混合物的总物质的量之比为2︰3,B正确;乙中I2浓度比甲中大,故乙中H2的转化率大于40%,C正确;平衡后,向乙中再加入0.1mol H2,建立新的平衡与甲中平衡为等效平衡,甲和乙中H2的百分含量相同,D不正确。
本题难度:一般
5、选择题 对于在一固定容积容器中发生的反应:2SO2(g)+ O2(g)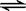 2SO3(g)(正反应为放热反应),下列措施中,既可加快反应速率,又可使平衡向右移动的是?
2SO3(g)(正反应为放热反应),下列措施中,既可加快反应速率,又可使平衡向右移动的是?
A.降温
B.减压
C.加催化剂
D.增加O2
参考答案:D
本题解析:略
本题难度:一般