微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%。
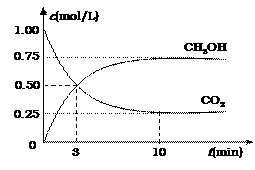
⑴ (2分)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e-?△H=+284kJ·mol-1
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s)?△H=+396kJ·mol-1
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200 kJ·mol-1
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
?。
⑵ (8分)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)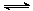 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
△H=-49.0 kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①?从反应开始到平衡,氢气的平均反应速率
v(H2)=?mol·(L·min)-1;
② 氢气的转化率=?;
③ 该反应的平衡常数为?(保留小数点后2位);
④ 下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是?。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1mol CO2和3mol H2
参考答案:⑴ (2分) 6CO2(g)+6H2O(l)=C6H12O6(葡萄糖、s)+6O2(g)?
△H=+2880kJ·mol-1
⑵ ①? 0.025 ;?② 75%;?③? 5.33(mol·L-1)-2
④? C、D(每空2分)
本题解析:略
本题难度:简单
2、填空题 恒温、恒压下,在一可变容器下反应,A(g) + B(g)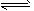 C(g)
C(g)
(1)开始时,放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的量为_____________mol
(2)若开始时放入3molA、3molB,到达平衡后生成C的物质的量为__________mol
(3)若开始时,放入XmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是Ymol和3amol,
则X=_____,Y=_____
(4)若在(3)的平衡状态上再加入3molC,待再次平衡后,C的物质的量分数是__________
参考答案:(1)1-a
(2)3a
(3)2;3(1-a)
(4)a/(2-a)
本题解析:
本题难度:一般
3、填空题 (10分)
恒温恒容下,将2mol A气体和2mol B气体通人体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min时反应达到平衡状态.此时剩余1.2mol B,并测得C的浓度为1
xC(g)+2D(s),2min时反应达到平衡状态.此时剩余1.2mol B,并测得C的浓度为1 .2mol·L-1。
.2mol·L-1。
(1)x=_______________;
(2)物质A的化学反应速率为________;A的转化率与B的转化率之比为_________;
(3)此反应在该温度时的化学平衡常数为_________
(4)保持温度和容积不变,向平衡体系中再充入2mol A和2mol B气体,达到新平衡时B的物质的量为_____________:
参考答案:(10分)
(1)3(2分)
(2)? 0.2 mol·L-1·min-1(2分)? 2∶1(2分)
(3)72(2分)
(4)2.4mol(2分)
本题解析:略
本题难度:一般
4、选择题 在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是?(?)
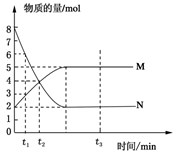
A.t2时M与N的物质的量浓度之比为1:1
B.t2与t3时刻的混合气体的平均相对分子质量相等
C.反应物与生成物平衡时的物质的量浓度之比是2:5
D.0~t2内用M表示的平均反应速率是 mol/(L?min)
mol/(L?min)
参考答案:B
本题解析:根据图像可知,反应从开始到平衡,N的物质的量减小,应为反应物,物质的量变化值为8mol-2mol=6mol;M的物质的量增多,应为是生成物,物质的量的变化值为5mol-2mol=3mol,根据物质的量的变化与化学计量数呈正比,则有n(N):n(M)=6mol:3mol=2:1,所以反应的化学方程式为2N M。由图象可以看出t2时M与N的物质的量均是4mol,所以二者的物质的量浓度之比为1:1,A正确;t2时M与N的物质的量还是变化的,反应没有达到平衡状态,而t3时刻物质的浓度不再发生变化,说明反应达到平衡状态。由于反应前后体积是变化的,所以混合气的平均相对分子质量是变化的,则t2与t3时刻的混合气体的平均相对分子质量不相等,B不正确;由图像可知,反应物与生成物平衡时的物质的量浓度之比是2:5,C正确;0~t2内用M表示的平均反应速率是
M。由图象可以看出t2时M与N的物质的量均是4mol,所以二者的物质的量浓度之比为1:1,A正确;t2时M与N的物质的量还是变化的,反应没有达到平衡状态,而t3时刻物质的浓度不再发生变化,说明反应达到平衡状态。由于反应前后体积是变化的,所以混合气的平均相对分子质量是变化的,则t2与t3时刻的混合气体的平均相对分子质量不相等,B不正确;由图像可知,反应物与生成物平衡时的物质的量浓度之比是2:5,C正确;0~t2内用M表示的平均反应速率是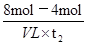 =
= mol/(L?min),所以选项D正确,答案选B。
mol/(L?min),所以选项D正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,综合性强,意在培养学生分析、归纳和总结问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。答题时注意把握图象中曲线的变化特点。
本题难度:一般
5、选择题 下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
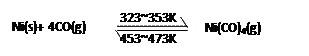

但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,下列说法正确的是
A.在石英管右端主要物质是Ni(CO)4(g)
B.在石英管右端主要物质是纯Ni(s)和CO(g)
C.在石英管左端主要物质是纯Ni(s)和CO(g)
D.整个过程可以看作CO(g)将Ni(s)从石英管左端转移到右端,从而达到提纯目的
参考答案:B D
本题解析:略
本题难度:简单