| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》在线测试(2017年最新版)(四)
参考答案:D 本题解析:构成盐的酸越弱,盐水解程度越大。A、 碳酸根离子的水解程度大于碳酸氢根离子,所以碳酸钠的碱性大于碳酸氢钠,碳酸钠溶液中氢离子浓度小于碳酸氢钠中的氢离子浓度,不选A;B、两种溶液中的阴离子种类相同,但是碳酸钠中钠离子浓度时碳酸氢钠中钠离子浓度的2倍,根据溶液中阴阳离子电荷守恒,所以碳酸钠中阴离子浓度大于碳酸氢钠中阴离子浓度,不选B;C、部分碳酸根离子水解成碳酸氢根离子,少量的碳酸氢根再水解成碳酸分子,水解程度依次减小,所以碳酸氢根离子浓度大于碳酸分子浓度。不选C;D、碳酸氢钠中碳酸氢根离子水解大于电离,所以水解出的碳酸分子浓度大于电离出的碳酸根离子浓度,选D。 本题难度:一般 2、选择题 下列溶液中微粒的浓度关于不正确的是 |
参考答案:B
本题解析:A、根据物料守恒,则c(Na+)= c(ClO-)+ c(HClO),正确;B、等体积、等物质的量浓度的NaX和弱酸HX混合,溶液若显酸性,则HX的电离程度大于其阴离子的水解程度,则c(Na+)< c(X-),错误;C、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液为等浓度的氯化铵和氨水的混合液,且溶液呈碱性,一水合氨的电离程度大于铵根离子的水解程度,所以c(NH4+)>c(Cl-)>c(NH3·H2O)> c(OH-)>c(H+),正确;D、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,根据电荷守恒,则有c(Na+)+c(H+)=" 2" c(S2-)+c(HS-)+c(OH-),正确,答案选B。
考点:考查溶液中离子浓度的比较
本题难度:困难
3、选择题 常温下a mol/L CH3COOH稀溶液和b mol/L KOH 稀溶液等体积混合,下列判断一定错误的是
A.若c(OH-)>c(H+),a=b
B.若c(K+)>c(CH3COO-),a<b
C.若c(OH-)=c(H+),a>b
D.若c(K+)<c(CH3COO-),a<b
参考答案:D
本题解析:A.若c(OH-)>c(H+),溶液为醋酸钾溶液或醋酸钾和KOH的混合液,则a≤b,A正确;B.若c(K+)>c(CH3COO-),由电荷守恒可知,c(OH-)>c(H+),则a≤b,B正确;C.若c(OH-)=c(H+),溶液显中性,一定为醋酸和醋酸钾的混合液,则a>b,C正确;D.若c(K+)<c(CH3COO-),由电荷守恒可知,c(OH-)<c(H+),则a>b,D错误;选D。
考点:考查溶液酸碱性的判断。
本题难度:一般
4、选择题 下列关系的表述中,正确的是
A.0.1mol·L-1NaHSO4溶液中:c(Na+)+ c(H+)= c(SO42-)+c(OH-)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
参考答案:C
本题解析:略
本题难度:一般
5、填空题 (6分)常温下,已知pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合后,所得溶液显酸性;0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性。请回答下列问题:
(1)高碘酸是 (填“强酸”或“弱酸”)
(2)0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合后所得溶液中,
c(IO3-) c(Na+)(填“大于”、“小于”或“等于”)。
(3)已知某溶液中只存在OH-、H+、IO4-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
A.c(Na+)>c(IO4-)>c(OH-)>c(H+)
B.c(IO4-)>c(Na+)>c(OH-)>c(H+)
C.c(Na+)>c(OH-)>c(IO4-)>c(H+)
D.c(IO4-)>c(Na+)>c(H+)>c(OH-)
填写下列空白:
①若溶液中只有一种溶质,则该溶质是 ,上述四种离子浓度大小顺序为________(填选项的标号)
②若上述关系中C项是正确的,则溶液中的溶质有 、
参考答案: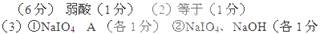
本题解析:略
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《有机合成与推断》.. | |