|
|
|
高考化学知识点总结《盐类水解的原理》在线测试(2017年最新版)(五)
2017-07-10 18:42:47
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是
选项
| 陈述Ⅰ
| 陈述Ⅱ
| A
| 明矾水解时产生具有吸附性的胶体粒子
| 明矾可作自来水消毒
| B
| Fe3+有氧化性
| FeCl3溶液可用于溶解回收旧电路板
中的铜
| C
| NH4Cl受热分解
| 加热可将Ca(OH)2和NH4Cl固体混合物分离
| D
| SO2具有氧化性
| SO2可用于漂白纸浆
|
2、选择题 室温下,下列溶液中粒子浓度关系正确的是
A.0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+ c(H2CO3)+ c(CO32-)
B.将0.2mol/LNaA溶液和某浓度的盐酸等体积混合所得中性溶液中:c(Na+)=c(A-) +c(Cl-) = 0.2mol/L
C.pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7
D.0.l mol·L-1氯化铵溶液滴加浓盐酸可能有c(NH4+) = c(H+)
|
3、选择题 关于浓度均为0.1 mol·L-1的三种溶液: ①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A.c(NH4+):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
|
4、填空题 (16分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
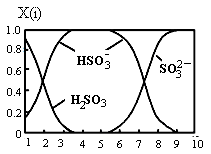
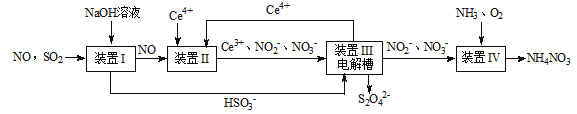
(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
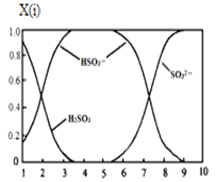
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程 式 , 。
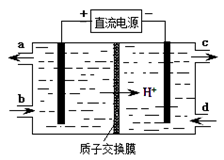
(4)装置Ⅲ还可以使Ce4+再生,其原理如图所示。①生成Ce4+从电解槽的 (填字母序号)口流出。②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
5、选择题 下列式子中,属于水解反应的是
[? ]
A.H2O+H2O H3O++OH-
H3O++OH-
B.HCO3-+OH-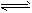 H2O+CO32-
H2O+CO32-
C.CO2+H2O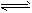 H2CO3
H2CO3
D.CO32-+H2O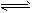 HCO3-+OH-
HCO3-+OH-




 H3O++OH-
H3O++OH-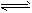 H2O+CO32-
H2O+CO32- H2CO3
H2CO3 HCO3-+OH-
HCO3-+OH-