微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验不能达到预期目的的是
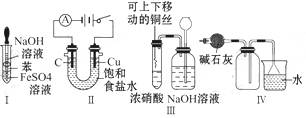
A.利用Ⅰ制取Fe(OH)2
B.利用Ⅱ装置电解饱和食盐水
C.利用Ⅲ装置进行铜与浓硝酸反应的实验
D.利用Ⅳ装置收集NH3
参考答案:B
本题解析:略
本题难度:一般
2、实验题 某化学课外活动小组在实验室设计了如下图所示的实验装置,进行“氨的催化氧化”实验。
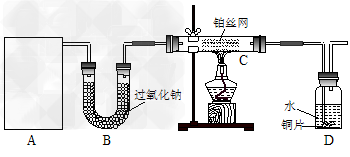
(1)A中制取气体时只用了一种药品,则该药品最好是______________(填化学式),图中空白处所需仪器应为____________________(选填下列仪器编号,固定装置省略)。
(2)该装置补充完整后,仍然存在一定缺陷,试从安全与环保的角度来考虑,对该装置进行改进①_____________________________;?②____________________________。
(3)按照改进后的装置进行实验,请完成以下问题:
①装置B的作用______________________________?;
②写出C中发生反应的化学方程式:______________________________?;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有_______________?。
参考答案:(1) NH4HCO3或(NH4)2CO3 ;?e、f、g、h
(2)①在装置C与D之间增加一个防倒吸装置 ;②在D后增加一个尾气吸收装置
(3)①吸收CO2和水蒸气,并生成O2? ;
②4NH3+5O2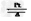 4NO+6H2O
4NO+6H2O
③铜片逐渐减少直至溶解,溶液变蓝色,生成无色气体并在广口瓶上方变成红棕色
本题解析:
本题难度:一般
3、实验题 某课外活动小组的同学共同设计了如图所示的实验装置(夹持仪器略),并用其进行下述实验
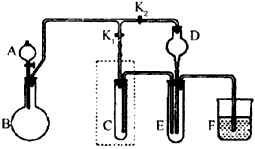
(1)实验1:制取并收集H2和Cl2。
①若制取并收集H2,则旋塞K1应该___________(填“打开”或“关闭”),旋塞K2应该_________(填“打开”或“关闭”)。H2收集在仪器_______(填表示仪器的英文字母)中。
②若将试管C中加满某种液体,可用于收集Cl2,这种液体最好选用____(填编号)。
a.饱和NaHCO3溶液 b.饱和NaCl溶液 c.NaOH溶液
(2)实验2:用干、湿两个有色布条验证干燥Cl2不具有漂白性而潮湿的Cl2具有漂白性。
①若用高锰酸钾与浓盐酸反应制取Cl2,实验前先将装置C改为如图所示装置,并应在D中加入_____(填代号)。
a.浓硫酸 b.氯化钙 c.碱石灰 d.碳酸氢钠

②润湿的有色布条应放在_______(填表示仪器的英文字母)中,干燥的有色布条应放在______(填表示仪器的英文字母)中。
参考答案:(1)①打开;关闭;C;②b
(2)①b;②C;E
本题解析:
本题难度:一般
4、选择题 分析推理是化学学习方法之一。下列实验推理中,正确的是
A.灼热的铂丝与NH3、O2混合气接触,铂丝保持红热,说明氨的氧化反应是放热反应
B.某雨水的pH小于5.6,说明雨水中一定溶解了SO2
C.某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中一定含有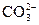
D.将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明镁比铝活泼
参考答案:A
本题解析:B错,NO2溶于水,也呈弱酸性;C错,也可能含Ag+或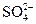 ;D错,发生氧化还原反应,该过程是原电池装置中的特例。
;D错,发生氧化还原反应,该过程是原电池装置中的特例。
本题难度:简单
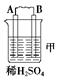
5、实验题 ?由A、B、C、D四种金属按下表中装置进行实验。
装置
| 
| 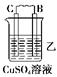
| 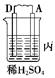
|
现象
| 二价金属A不断溶解
| C的质量增加
| A上有气体产生
|
根据实验现象回答下列问题:
(1)装置甲中电子流向是①_____________,溶液中H+向②____极移动.(用A、B填空)
装置甲中负极的电极反应式是③_____________________________________________。
(2)装置乙中B的金属性比C④_____,正极的电极反应式是⑤______________________。
(3)装置丙中A极的电极反应是⑥_______________,溶液的pH⑦________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是⑧_______________________________________。
(5).当丙中A极产生的气体在标准状况下为2.24L时,D极失去的电子的物质的量为⑨____________.若D为Zn,则D极质量减轻⑩_______g.
参考答案:.(1) ①A→B?②B?③ A -2e-=A2+ (2)④活泼(或强)?⑤? Cu-2e-=Cu2+
(3)⑥ 2H++2e-=H2 ↑?⑦变大? (4)⑧D>A>B>C? (5)⑨0.2mol⑩6.5g
本题解析:(1)金属不断溶解,说明A是负极,B是正极,金属所失去的电子经导线传递到正极B上,所以溶液中的阳离子氢离子向正极方向移动。
(2)C的质量增加,说明C是正极,B是负极,因此金属性是B大于C。溶液中的铜离子在正极得到电子,发生氧化反应。
(3)A上有气泡,说明A是正极,D是负极。溶液中的氢离子在正极得到电子发生还原反应生成氢气,氢离子浓度减小,pH增大。
(4)根据以上分析可知金属性强弱是D>A>B>C。
(5)氢气是0.1mol,转移电子是0.1mol。根据得失电子守恒可知,被氧化的锌是0.1mol,质量是6.5g。
本题难度:一般