微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?___________。
(2)生石灰可做干燥剂的理由是___________(用化学方程式表示)。
(3)生石灰还可以跟哪些类别的物质发生化学反应?列举三例,写出化学方程式:
__________________,_________________,_____________________
(4)小纸袋中的物质能否长期持续地做干燥剂?为什么?________________________。
参考答案:(1)金属氧化物
(2)CaO+H2O=Ca(OH)2
(3)CaO+2HCl=CaCl2+H2O;CaO+CO2=CaCO3(或CaO+SiO2 CaSiO3);H2O+CaO+Na2CO3=CaCO3↓+
CaSiO3);H2O+CaO+Na2CO3=CaCO3↓+
2NaOH
(4)不能,当CaO与水反应全部生成Ca(OH)2[Ca(OH)2也有吸水性],Ca(OH)2再潮解表面呈黏稠状时,即失去干燥剂的作用
本题解析:
本题难度:一般
2、实验题 (17分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:

称取研细的黄铜矿样品1.150g,在空气存在的条件下进行煅烧。实验后取d中溶液的1/10置于锥形瓶中,用0.05mo1/L标准碘溶液进行滴定,初读数为0.10mL,终读数如右上图所示。
(1)黄铜矿煅烧的反应为8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2,该反应中被还原的元素是___(填元素符号)。
(2)标准碘溶液应盛放在(填“碱式”或“酸式”)________滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是:?。请用化学方程式表示滴定的原理:?。
(3)滴定终点的读数为?mL;通过计算可知,该黄铜矿的纯度为?。
(4)若去掉c装置,会使测定结果??(填“偏低”“偏高”或“无影响”)。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,可能的原因主要有?。
参考答案:(17分) (1)Cu、O(2分,各1分)
(2)酸式(2分);往滴定管上口加入3~5mL标准碘溶液,倾斜转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放出(3分,每个要点给1分);
SO2+I2+2H2O=H2SO4+2HI? (或H2SO3+I2+H2O=H2SO4+2HI)(2分,配平错误扣1分)
(3)20.10(2分,数位错的不给分);80.4%(2分)?(4)偏低(2分)
(5)二氧化硫未能被水充分吸收,亚硫酸部分被氧化(2分,各1分)
本题解析:(1)根据方程式可知铜元素的化合价从+2价降低到0价,氧元素的化合价从化0价降低-2价,被还原。硫元素的化合价从-1价升高到+4价,铁元素的化合价从+2价部分升高到+3价,被氧化。
(2)标准碘溶液显酸性应盛放在酸式滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是往滴定管上口加入3~5mL标准碘溶液,倾斜转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放出。SO2检验还原性能被单质碘氧化,则表示滴定原理的方程式为SO2+I2+2H2O=H2SO4+2HI。
(3)滴定管自上而下刻度逐渐增大,且能精确到0.1mol,所以根据装置图可知滴定终点的读数为20.10?mL;因此根据方程式SO2+I2+2H2O=H2SO4+2HI可知消耗SO2的物质的量是0.05mo1/L×0.02010L=0.001005mol,则原矿石中产生的SO2是0.001005mol×10=0.01005mol,所以根据方程式8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2可知CuFeS2的物质的量是0.01005mol÷2=0.005025mol,其质量为0.005025mol×184g/mol=0.9246g,则该黄铜矿的纯度为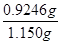 ?×100×=80.4%.
?×100×=80.4%.
(4)铜网的作用是除去未反应的氧气,氧气具有氧化性,如果没有装置c,则导致SO2与碘反应时消耗碘溶液的体积减少,从而导致纯度偏低。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,这说明消耗的标准液碘的体积偏少,因此可能的原因主要有二氧化硫未能被水充分吸收或亚硫酸部分被氧化。
本题难度:一般
3、填空题 (Ⅰ)(6分)配平下列氧化还原反应方程 式:
式:
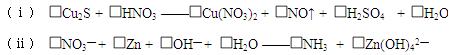
(Ⅱ)(10分)某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
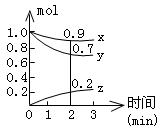
(1)计算反应开始2min内的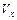 = ,
= , 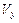 = ,
= , = ,
= ,
(2)容器内的反应物是 。
(3)写出该反应的化学方程式 。
参考答案:(6分,每题3分)(1)(
本题解析:
本题难度:一般
4、选择题 某氮的氧化物和CO在催化剂存在下充分反应,生成物质的量之比为1︰2的N2和CO2,该氧化物是(?)
A.N2O
B.NO
C.NO2
D.N2O5
参考答案:B
本题解析:氮气是还原产物,CO2是氧化产物。根据得失的得失守恒可知,生成1mol氮气,转移4mol电子,所以平均1个氮原子得到2个电子,因此氧化物中氮元素的化合价是+2价,选项B正确,答案选B。
本题难度:一般
5、选择题 a mol FeS与b mol FeO投入V L、c mol·L-1的稀硝酸溶液中充分反应,产生NO气体,
所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为(?)
①(a+b)×63 g?②(a+b)×189 g
③(a+b) mol?④(cV- ) mol
) mol
A.①④
B.②③
C.①③
D.②④
参考答案:D
本题解析:涉及氧化还原反应的知识往往是多种守恒原理的综合运用。本题综合运用原子守恒与电子得失守恒来求解。从题中叙述可知,该反应的产物主要有三种:Fe(NO3)3、H2SO4和NO,其中Fe(NO3)3中硝酸根离子的物质的量等于未被还原的硝酸的物质的量,由原子守恒得出生成的Fe(NO3)3的物质的量为(a+b) mol,则未被还原的硝酸的物质的量为3(a+b) mol,再乘以硝酸的摩尔质量可得出②是正确的。该反应中生成的NO是还原产物,a mol FeS被氧化失去9a mol电子,b mol FeO被氧化失去b mol电子,由得失电子守恒可知生成NO的物质的量为 ?mol,再结合原子守恒可得出④是正确的。
?mol,再结合原子守恒可得出④是正确的。
本题难度:一般