微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某体系中存在如下反应:
① H2S+4H2O-8e → SO42-+10H+?② 2IO3-+12 H++10e → I2+6H2O?
(1)反应①中H2S做_______剂,反应②属于_______ 反应(填“氧化”或“还原”)。
(2)若在反应①中失去0.2 mol 电子,则反应②中可生成??g 碘。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:
_______________________________________________________________________
(4)由上述反应可推知?。
a.氧化性:K2SO4> KIO3? b.酸性:H2S> H2SO4
c.还原性: H2S > I2? d.反应过程中溶液的酸性逐渐减弱
2、填空题 某化学方程式由下列5种物质组成:S、H2S、HNO3、NO、H2O。
⑴请将除H2S以外的4种物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
H2S+_____→_____+_____+_____
⑵反应物中被还原的元素是__________。
⑶请将反应物的化学式及配平后的系数填入下列相应的位置中,并用单线桥法表示电子转移的方向和数目:____H2S+_____→_____+_____+_____
⑷反应中每消耗标准状况下3.36L H2S气体,转移电子的数目为_____。
3、填空题 (13分)化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO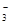 还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
【 已知:pH=-lgc(H+),常温下,水溶液中c(H+)×c(OH-)=10-14 】
①N2的结构式为________。
②请补充离子方程式,并进行配平:上述反应离子方程式为(配平为1不省略)
( )NO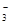 +( )H2催化剂 ( )N2+( )H2O+( )__________,
+( )H2催化剂 ( )N2+( )H2O+( )__________,
其平均反应速率v(NO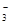 )= mol·L-1·min-1。
)= mol·L-1·min-1。
(2)电化学降解NO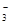 的原理如图所示。
的原理如图所示。
①电源正极为________(填“A”或“B”),
阴极反应式为 。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
4、填空题 在常见的非金属及其化合物中:
(1)晶体硅的导电性介于导体和绝缘体之间,是良好的?材料;硅酸钠水溶液俗称为?,是制备硅胶和木材防火剂的原料;陶瓷、?、水泥等硅酸盐产品是使用量最大的无机非金属材料。
(2)氯元素是重要的“成盐元素”,将氯气通入NaOH溶液中可以得到漂白液,反应的离子方程式是?;漂白液有效成分的化学式为?。
(3)水是常见的非金属元素化合物,请按要求写出下列水参加的反应的化学方程式。
①水只作氧化剂:?
②NO2气体通入水中:?
③水既作氧化剂又作还原剂:?
5、计算题 用KMnO4氧化密度为1.19g·cm-3。溶质质量分数为36.5%的HCl溶液。反应方程式如下:
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
(1)15.8gKMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl2在标准状况下的密度为3.17g·L-1,则产生的Cl2?在标准状况下的体积为多少?