微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某体系中存在如下反应:
① H2S+4H2O-8e → SO42-+10H+?② 2IO3-+12 H++10e → I2+6H2O?
(1)反应①中H2S做_______剂,反应②属于_______ 反应(填“氧化”或“还原”)。
(2)若在反应①中失去0.2 mol 电子,则反应②中可生成??g 碘。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:
_______________________________________________________________________
(4)由上述反应可推知?。
a.氧化性:K2SO4> KIO3? b.酸性:H2S> H2SO4
c.还原性: H2S > I2? d.反应过程中溶液的酸性逐渐减弱
参考答案:(1)还原,还原。(各1分 ,共2分)(2)5.08 g 碘。(1分)
 ?
?
(3)5H2S+8KIO3 ="==" 4K2SO4+4I2 +H2SO4+4H2O
(2分,方程式1分,电子转移的方向和数目1分)?
(4)c( 1分)
本题解析:略
本题难度:一般
2、填空题 某化学方程式由下列5种物质组成:S、H2S、HNO3、NO、H2O。
⑴请将除H2S以外的4种物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
H2S+_____→_____+_____+_____
⑵反应物中被还原的元素是__________。
⑶请将反应物的化学式及配平后的系数填入下列相应的位置中,并用单线桥法表示电子转移的方向和数目:____H2S+_____→_____+_____+_____
⑷反应中每消耗标准状况下3.36L H2S气体,转移电子的数目为_____。
参考答案:⑴H2S+HNO3→ S+NO+H2O
⑵N(氮)
⑶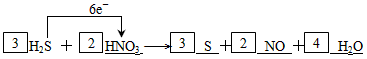
⑷1.806×1023(0.3NA)
本题解析:
本题难度:一般
3、填空题 (13分)化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO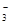 还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
【 已知:pH=-lgc(H+),常温下,水溶液中c(H+)×c(OH-)=10-14 】
①N2的结构式为________。
②请补充离子方程式,并进行配平:上述反应离子方程式为(配平为1不省略)
( )NO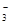 +( )H2催化剂 ( )N2+( )H2O+( )__________,
+( )H2催化剂 ( )N2+( )H2O+( )__________,
其平均反应速率v(NO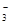 )= mol·L-1·min-1。
)= mol·L-1·min-1。
(2)电化学降解NO 的原理如图所示。
的原理如图所示。
①电源正极为________(填“A”或“B”),
阴极反应式为 。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
参考答案:(1)①N≡N (2分)
②2NO3?+5H2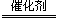 N2+2OH?+4H2O (3分,配平全对的2分,OH?对的1分) 0.001 (2分)
N2+2OH?+4H2O (3分,配平全对的2分,OH?对的1分) 0.001 (2分)
(2)① A (2分)2NO3?+6H2O+10e?=N2↑+12OH? (3分)
②14.4 (3分)
本题解析:(1)①N2分子内N原子间形成了氮氮三键,所以结构式为:N≡N。
②根据原子守恒和电荷守恒,生成物还有OH?,根据化合价变化,N元素由+5价降低为0价,以N2为研究对象,共降低10价,H2中H元素由0价升高至+1价,共升高2价,根据化合价升高和降低的价数相等,配平可得离子方程式:2NO3?+5H2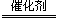 N2+2OH?+4H2O;根据pH=-lgc(H+),pH由7变为12,则溶液中H+浓度由10-7变为10-12,根据水溶液中c(H+)×c(OH-)=10-14 ,可得?c(OH?)=0.01mol?L?1,则v(NO)=0.01mol?L?1÷10min=0.001 mol·L-1·min-1。
N2+2OH?+4H2O;根据pH=-lgc(H+),pH由7变为12,则溶液中H+浓度由10-7变为10-12,根据水溶液中c(H+)×c(OH-)=10-14 ,可得?c(OH?)=0.01mol?L?1,则v(NO)=0.01mol?L?1÷10min=0.001 mol·L-1·min-1。
(2)①电解池的右侧NO3?转化为N2,N元素得电子发生还原反应,则Ag—Pt为电解池的阴极,B为电源的负极,所以电源正极为A;阴极发生NO3?得电子生成N2,根据化合价和电子转移、原子守恒、电荷守恒可得电极反应式为:2NO3?+6H2O+10e?=N2↑+12OH?
②电解池的左侧发生反应:2H2O—4e?=4H++O2↑,若电解过程中转移了2 mol电子,放出0.5mol O2,2mol H+通过质子交换膜移向右侧,左侧电解质溶液质量减少:0.5mol×32g/mol+2mol×1g/mol=18g,电解池的右侧发生反应:2NO3?+6H2O+10e?=N2↑+12OH?,若电解过程中转移了2 mol电子,放出0.2mol N2,从左侧进入2g H+,所以右侧电解质溶液质量减少:0.2mol×28g/mol—2g=3.6g,则膜两侧电解液的质量变化差(Δm左-Δm右)为:18g—3.6g=14.4g。
考点:本题考查物质的结构与性质、方程式的书写、电解原理及相关计算。
本题难度:困难
4、填空题 在常见的非金属及其化合物中:
(1)晶体硅的导电性介于导体和绝缘体之间,是良好的?材料;硅酸钠水溶液俗称为?,是制备硅胶和木材防火剂的原料;陶瓷、?、水泥等硅酸盐产品是使用量最大的无机非金属材料。
(2)氯元素是重要的“成盐元素”,将氯气通入NaOH溶液中可以得到漂白液,反应的离子方程式是?;漂白液有效成分的化学式为?。
(3)水是常见的非金属元素化合物,请按要求写出下列水参加的反应的化学方程式。
①水只作氧化剂:?
②NO2气体通入水中:?
③水既作氧化剂又作还原剂:?
参考答案:(1)半导体?水玻璃?玻璃
(2)Cl2+2OH-=Cl-+ClO-+H2O? NaClO
(3)①2Na+2H2O 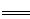 2NaOH+H2↑ 等
2NaOH+H2↑ 等
②3NO2+H2O  2HNO3+NO
2HNO3+NO
③2H2O  2H2↑+O2↑
2H2↑+O2↑
本题解析:(1)晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料,硅酸钠水溶液俗
称为水玻璃,陶瓷、玻璃、水泥是使用量最大的无机非金属材料;
(2)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠、水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,其中漂白液有效成分是次氯酸钠,化学式为NaClO;
(3)①水只作氧化剂:钠与水的反应、铁与水蒸气的反应、碳与水蒸气的反应等,
②NO2气体通入水中生成硝酸和一氧化氮,化学方程式为3NO2+H2O  2HNO3+NO,
2HNO3+NO,
③水既作氧化剂又作还原剂,水的电解,2H2O  2H2↑+O2↑
2H2↑+O2↑
本题难度:一般
5、计算题 用KMnO4氧化密度为1.19g·cm-3。溶质质量分数为36.5%的HCl溶液。反应方程式如下:
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
(1)15.8gKMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl2在标准状况下的密度为3.17g·L-1,则产生的Cl2?在标准状况下的体积为多少?
参考答案:(1)29.2 g? 18.25 g? (2)5.6 L
本题解析:设参加反应的HCl的质量为m(HCl),反应生成的Cl2质量为m(Cl2)
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
316? 584? 355
15.8g? m(HCl)? m(Cl2)
m(HCl)=15.8g×584/316=29.2g
m(Cl2)=15.8g×355/316=17.75g
(1)参加反应的HCl的质量为29.2g,其中被氧化的HCl的质量为参加反应的HCl总质量的10/16,则被氧化的HCl的质量为29.2g×10/16=18.25g
(2)产生氯气的体积为17.75g/3.17g·L-1=5.6L
本题难度:简单