微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)写出下列物质的电离方程式(在水溶液中)。
(1)H2SO4?;
(2)H2CO3?;
(3)NaHSO4?;
(4)NaHCO3 ?;
?;
(5)Cu(OH)2?。
参考答案:略
本题解析:略
本题难度:一般
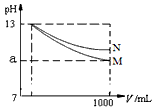
2、选择题 pH=13的两种碱溶液M、N各1mL,分别加水稀释到1000mL,其pH与溶液体积(V/mL)的关系如图所示,下列说法正确的是
[? ]
A.M、N两种碱溶液的物质的量浓度一定相等
B.稀释后,M溶液的碱性比N溶液强
C.若a=10,则M是强碱,N是弱碱
D.若10<a<13,则M、N都是弱碱
参考答案:CD
本题解析:
本题难度:一般
3、选择题 下列事实一定能证明?HNO2?是弱酸的是( )
①常温下NaNO2?溶液的pH?大于?7;
②用?HNO2?溶液做导电实验,灯泡很暗;
③0.1mol?L?-1的?HNO2?溶液的p?H=2.1;
④NaNO2?和?H3PO4反应,生成HNO2;
⑤pH=3的?HNO2?溶液稀释至100倍后,pH小于5.
A.①③⑤
B.①②④
C.①③④⑤
D.全部
参考答案:①由盐类水解的规律,强酸强碱盐的水溶液为中性,但弱酸强碱盐水的pH大于7,则说明盐对应的HNO2是弱电解质,故正确;
②溶液的导电性与离子的浓度有关,弱电解质的浓度大时导电实验中灯泡也很亮,没有对比实验,无法说明HNO2是弱电解质,故错误;
③0.1mol?L?-1的?HNO2?溶液,如果是强酸,溶液的pH=1,实际上溶液的p?H=2.1,则说明该酸不完全电离,是弱电解质,故正确;
④NaNO2?和?H3PO4反应,磷酸是中强酸,根据强酸制取弱酸知,亚硝酸的酸性小于磷酸,所以亚硝酸是弱酸,故正确;
⑤pH=3的?HNO2?溶液稀释至100倍,假设亚硝酸是强酸,稀释后溶液的pH为5,实际上溶液的pH小于5,说明亚硝酸不完全电离,为弱酸,故正确;
故选C.
本题解析:
本题难度:一般
4、填空题 北京奥运会“祥云”火炬的燃料是丙烷(C3H8),亚特兰大奥运会火炬的燃料是丙烯(C3H6)。 (1)丙烷脱氢可得丙烯。
已知:C3H8(g)―→CH4(g)+HC≡CH(g)+H2(g)? ΔH1=156.6?kJ/mol
CH3CH=CH2(g)―→CH4(g)+HC≡CH(g) ΔH2=32.4?kJ/mol
则相同条件下,反应C3H8(g)―→CH3CH=CH2(g)+H2(g)的ΔH=________kJ/mol。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为_____________;放电时,CO32-移向电池的________(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5?mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3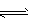 HCO3-+H+?的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
HCO3-+H+?的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
(4)常温下,溶液中c(H2CO3)________c(CO32-)(填“>”“=”或“<”),原因是___________________________(用离子方程式和必要的文字说明)。
参考答案:(1)124.2
(2)C3H8+5O2===3CO2+4H2O ;负
(3)4.2×10-7?mol/L
(4)> ;HCO3-+H2O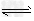 CO32-+H3O+(或HCO3-
CO32-+H3O+(或HCO3-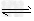 CO32-+H+),HCO3-+H2O?
CO32-+H+),HCO3-+H2O?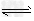 H2CO3
H2CO3
本题解析:
本题难度:一般
5、选择题 pH值相同,体积也相同的稀硫酸和醋酸溶液,分别同时与过量锌粒反应,则正确的描述是
[? ]
A.开始时产生H2的速率:硫酸大于醋酸
B.开始时产生H2的速率:醋酸大于硫酸
C.经过t s时产生H2速率:醋酸大于硫酸
D.产生等量H2所需时间,醋酸小于硫酸
参考答案:CD
本题解析:
本题难度:一般