微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
实验方案
| 实验现象
|
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞
| A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色
|
②向新制的H2S饱和溶液中滴加新制的氯水
| B.产生大量气体,可在空气中燃烧,溶液变成浅红色
|
③钠与滴有酚酞试液的冷水反应
| C.反应不十分剧烈,产生的气体可以在空气中燃烧
|
④镁带与2mol·L-1的盐酸反应
| D.剧烈反应,产生的气体可以在空气中燃烧
|
⑤铝条与2mol·L-1的盐酸反应
| E.生成白色胶状沉淀,继而沉淀消失
|
⑥向氯化铝溶液中滴加氢氧化钠溶液
| F.生成淡黄色沉淀
|
请你帮助该同学整理并完成实验报告。
(1)实验目的:________________________。
(2)实验仪器: _________________________;
(3)实验内容:请将实验方案与实验现象一一对应(*填写题给信息表中的序号),写出化学方程式
?(4)实验结论:_______________________________。
(5)请用结构理论简单说明具有上述结论的原因。
(6)请你补充一组事实,说明此周期中另外两种元素的性质递变规律。
参考答案:(1)这一套实验目的是“验证第三周期元素从左到右金属性递减、非金属性递增的规律。”
(2)回忆每个实验过程可知,这些实验要用到的仪器有:试管、酒精灯、镊子、小刀、玻璃片、胶头滴管等。
(3)根据元素周期表第三周期元素的排列顺序,可确定实验操作顺序和相关的实验现象等(如下表)。
实验方案
实验现象
有关化学方程式
3
A
2Na+2H2O=2NaOH+H2↑
1
B
Mg +2H2O= Mg(OH)2+H2↑
4
D
Mg+2HCl=MgCl2+H2↑
5
C
2Al+6HCl=2AlCl3+3H2↑
6
E
AlCl3+3NaOH=Al(OH)3↓+3NaCl
Al(OH)3+NaOH=NaAlO2+2H2O
2
F
H2S+Cl2=2HCl+S↓
(4)金属性:Na>Mg>Al; 非金属性:S<Cl。
(5)Na、Mg、Al、S、C,原子核外都有三个电子层,但原子半径随电子数增多而减小,所以核对最外层电子的吸引力依次增强,失电子能力减弱,得电子能力增强。
(6)硅酸是弱酸,磷酸是中强酸。(合理即可)
本题解析:⑴由题知该实验目的是“验证第三周期元素从左到右金属性递减、非金属性递增的规律。”
⑵所需实验仪器有:试管、烧杯、酒精灯、镊子、小刀、玻璃片、胶头滴管、滤纸等。
⑶、①③④⑤⑥探究的是Na、Mg、Al的金属性强弱,②可比较S和Cl的非金属性强弱,实验方案与现象对应关系为:①对应B②对应F③对应A④对应D⑤对应C⑥对应E,具体见答案。
⑷根据金属与水或与酸反应的剧烈程度,最高价氧化物的水化物的碱性强弱知金属性:Na>Mg>Al;
非金属性强弱的比较可根据同周期由左向右非金属性逐渐增强、与氢气化合的难易、最高价含氧酸酸性强弱、单质间的置换反应等来比较判断,则非金属性:S<Cl;
⑸同周期由左向右原子半径逐渐减小,核电核数逐渐增大,则原子核对核外电子的吸引能力逐渐增强即失电子能力减弱,得电子能力增强。
⑹该周期另外两种元素为硅、磷,可向硅酸钠溶液中滴加磷酸,有白色胶状沉淀产生,表明磷酸酸性比硅酸酸性强,则磷的非金属性比硅强。
本题难度:一般
2、选择题 下列各组中的两种物质熔化时克服的作用力不同的是(?)
A.干冰、SO3晶体
B.食盐、烧碱
C.氧化镁、冰
D.氮气、氩
参考答案:C
本题解析:A、D需克服分子间力,B需克服离子键。
本题难度:一般
3、选择题 下列关于Fe(OH)3胶体的叙述不正确的是
A.Fe(OH)3胶体是一种红褐色、澄清、透明的混合物
B.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
C.Fe(OH)3胶体中分散质的微粒直径在10-9m~10-7m之间
D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
参考答案:B
本题解析:分析:A、从胶体是均一稳定的分散系分析判断;
B、胶体能发生丁达尔现象,溶液没有;
C、胶体分散系中的分散质微粒直径在1nm-100nm间,1nm=10-7m;
D、Fe(OH)3胶体微粒能吸附水中悬浮的杂质.
解答:A、Fe(OH)3胶体是饱和氯化铁在沸水中生成的均一稳定的分散系,是一种红褐色、澄清、透明的混合物,故A正确;
B、用平行光照射NaCl溶液和Fe(OH)3胶体时,NaCl溶液无现象,Fe(OH)3胶体出现光亮的通路,故B错误;
C、Fe(OH)3胶体中分散质的微粒直径在10-9m~10-7m之间,故C正确;
D、Fe(OH)3胶体粒子有较大的表面积,具有一定吸附作用,能够使水中悬浮的固体颗粒沉降,达到净水目的,故D正确;
故选B.
点评:本题考查了胶体的组成、性质、判断,明确与溶液的区别、本质特征和胶体的性质应用即可解答.
本题难度:一般
4、选择题 在周期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中正确的是(?)
A.原子半径:丙>乙>甲>丁
B.气态氢化物的稳定性:甲>丙
C.最高价氧化物对应水化物的酸性:丁>甲
D.乙和甲或乙和丁所能形成的化合物都是有毒物质
参考答案:B
本题解析:考查周期表的结构。甲元素与乙、丙、丁三元素相邻,且四种元素原子的最外层电子数之和为20,所以甲的最外层电子数是5。又因为甲、乙的原子序数之和等于丙的原子序数,所以甲是N,乙是O,丙是P,丁是C。原子半径是P>C>N>O,A不正确。N的非金属性强于P的,所以N的氢化物的稳定性强于P的氢化物的稳定性,B正确。C的非金属性弱于N的,所以碳酸的酸性弱于硝酸的,C不正确。CO2不是有毒物质,D不正确。答案选B。
本题难度:简单
5、选择题 R为1~18号元素,其原子所具有的电子层数为最外层电子数的,它可能形成的含氧酸根离子有: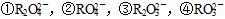 ,下列叙述判断正确的是(?)
,下列叙述判断正确的是(?)
A.当它可以形成①时,不可能形成④
B.当它可以形成②时,可以形成④
C.当它可以形成①时,不可能形成②和③
D.当它形成②时,也可以形成①
参考答案:B
本题解析:根据提示可知,R可能为C或S。如果是C,含氧酸根可以是①③④,如果是S,含氧酸根可以是②③④。所以正确的选项是B。
点评:本题从元素推断考查到元素的化合价,同种元素可以形成不同化合价的含氧酸根,但是其最高化合价不能超过最外层的电子数。
本题难度:一般