微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验操作及现象能够达到对应实验目的的是
?
| 实验内容
| 实验目的
|
A
| 将SO2通入品红溶液中,品红褪色;加热褪色后品红溶液,溶液恢复红色
| 证明亚硫酸的不稳定性
|
B
| 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生
| 证明常温下KSP(BaSO4)>KSP(BaCO3)
|
C
| 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH
| 证明相同条件下,在水中HCl电离程度大于CH3COOH
|
D
| 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊
| 检验气体产物中CO2的存在
|
?
参考答案:C
本题解析:A、将SO2通入品红溶液中,品红褪色;加热褪色后品红溶液,溶液恢复红色,这说明SO2的漂白是不稳定的,而不能说明亚硫酸的不稳定性,A不正确;B、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生,这说明反应中有碳酸钡沉淀产生,这与碳酸钡和硫酸钡的溶度积常数并无直接关系。因为只要溶液中c(Ba2+)·c(SO42-)>KSP(BaCO3)即可产生碳酸钡沉淀,B不正确;C、常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH,这说明盐酸溶液中氢离子浓度大于醋酸溶液中氢离子浓度。因此在物质的量浓度相同的条件下,说明盐酸的电离程度要大于醋酸的电离程度,C正确;D、在加热的条件下浓硫酸与碳加热反应生成CO2、SO2和水。由于SO2也能和澄清石灰水反应产生白色沉淀,所以根据石灰水变浑浊不能说明有CO2生成,D不正确,答案选C。
本题难度:一般
2、实验题 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Al和不同浓度的硫酸(0.5?mol·L-1、2?mol·L-1、18.4?mol·L-1)。设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:?

(1)甲同学表中实验步骤②为__________________
(2)甲同学的实验目的是__________________要得出正确的实验结论,还需控制的实验条件是__________________
(3)乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。乙同学在实验中应该测定的数据是______________________
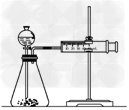
(4)乙同学完成该实验应选用的实验药品是________________该实验中不选用某浓度的硫酸,理由是________________________
参考答案:(1)分别投入大小、形状相同的Cu、Fe、Al
(2)研究金属(或反应物)本身的性质与反应速率的关系;温度相同
(3)一定时间内产生气体的体积(或产生一定体积的气体所需时间)
(4)Fe(或Al)、0.5 mol·L-1硫酸和2 mol·L-1硫酸;常温下Fe(或Al)在18.4 mol·L-1硫酸中钝化
本题解析:
本题难度:一般
3、实验题 (8分)某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2,该同学推测反应中可能生成了H2O2,并进行实验探究。
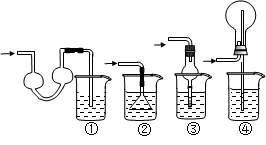
(1)写出Na2O2与水反应的化学方程式?。
(2)试设计实验证明溶液X中含过氧化氢?。
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:?H2O2 +?Fe2+ +?OH-— ?Fe(OH)3?,该反应中H2O2表现了?性(填“氧化”或“还原”)。
(4)已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了?性(填“氧化”或“还原”)。
参考答案:(8分)
(1)2 Na2O2 + 2 H2O = 4 NaOH + O2↑(2分)
(2)取溶液X少量于洁净的试管中,加入适量MnO2粉末,用带火星的木条检验,若木条复燃证明有H2O2(2分)
(3)1、2、4、2(2分);氧化性(1分)
(4)还原性(1分)
本题解析:Na2O2与水反应的化学方程式是2 Na2O2 + 2 H2O = 4 NaOH + O2↑;证明溶液X中含过氧化氢的方法是:取溶液X少量于洁净的试管中,加入适量MnO2粉末,用带火星的木条检验,若木条复燃证明有H2O2;通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成 红褐色沉淀,配平下列反应的离子方程式:1H2O2 +2Fe2+ +?4OH-=2?Fe(OH)3?,该反应中H2O2表现了氧化性;已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现还原性。2O2与水的反应
点评:有关Na2O2与水的反应的知识来自于教材,此题要结合实验的目的,注意分析实验过程。
本题难度:一般
4、选择题 只用一种试剂就能鉴别Ba(NO3)2、Na2CO3、K2SO4三种溶液,该试剂是( )
A.KNO3溶液
B.稀H2SO4
C.NaOH溶液
D.Na2SO4溶液
参考答案:A.加入KNO3溶液与三种物质都不反应,故A错误;
B.加入稀H2SO4,与Ba(NO3)2反应生成白色沉淀,与Na2CO3反应生成气体,与K2SO4不反应,三者现象各不相同,可鉴别,故B正确;
C.加入NaOH溶液,与三种物质都不反应,故C错误;
D.加入Na2SO4溶液不能鉴别Na2CO3、K2SO4,故D错误.
故选B.
本题解析:
本题难度:简单
5、实验题 下图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、试管夹均未画出)。图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝或银丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液。

(1)在上述装置中,实验需要加热的仪器为(填序号)?。
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是?。
(3)若E中的固体为纯净物,则E的化学式是?。
参考答案:(1)E、A、B、F?(2)水浴加热?(3)KMnO4
本题解析:(1)固体加热制氧气需要加热,乙醇变为蒸汽需加热,乙醇的催化氧化要加热,醛和新制氢氧化铜
的反应也要加热,所以答案为E、A、B、F。
(2)为使A中乙醇平稳气化成乙醇蒸气,则需要控制溶液的温度,因此常采用的方法是水浴加热。
(3)固体纯净物加热制氧气的只能是加热高锰酸钾制氧气,因为氯酸钾需要二氧化锰做催化剂,所以反应的
化学方程式为2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
点评:本题是一道考查乙醇化学性质的综合实验题,试题基础性强,难易适中。主要是考查学生对基础知识的
理解掌握程度以及灵活运用知识解决实际问题的能力,有利于培养学生的综合实验能力,增强学生学习化学的
兴趣和学习积极性。
本题难度:一般