微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)下图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度为________ mol·L-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀H2SO4,则需取________ mL的该硫酸,将上述硫酸进行稀释的实验操作为
________________________________________________________________________。
(3)在配制4.6 mol·L-1的稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中:________;
②容量瓶用1 mol·L-1的稀H2SO4润洗:________;
③定容时俯视液面读数:________。
参考答案:(1)18.4
(2)60 将浓硫酸沿器壁缓慢注入水中,并不断用玻璃棒搅拌溶液
(3)①偏高 ②偏高 ③偏高
本题解析:(1)由溶质的质量分数求物质的量浓度时可依据公式c=来计算,代入数据可求得,c=18.4mol·L-1;
(2)由稀释前后溶质的物质的量不变可知,18.4mol·L-1×V=4.6mol·L-1×0.24 L,则V=0.06 L;
(3)未经冷却趁热将溶液注入容量瓶中,冷却后造成溶液体积变小,导致溶液浓度偏高;容量瓶用1mol·L-1的稀H2SO4润洗,溶质的物质的量变大,导致溶液浓度偏高;定容时俯视液面读数,加水量减少,结果偏高。
本题难度:简单
2、选择题 下列实验方案中,不能达到实验目的的是
选项
| 实验目的
| 实验方案
|
A
| 检验CH3CH2Br在NaOH溶液中是否发生水解
| 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液用稀HNO3酸化加入AgNO3溶液,观察是否产生淡黄色沉淀
|
B
| 检验Fe(NO3)2晶体是否已氧化变质
| 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
|
C
| 验证Br2的氧化性强于I2
| 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色
|
D
| 验证Fe(OH)3的溶解度小于Mg(OH)2
| 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
参考答案:B
本题解析:A、溴乙烷在氢氧化钠的溶液中加热发生水解生成乙醇、溴化钠。在酸性条件下溴化钠与硝酸银溶液反应产生淡黄色沉淀溴化银,能达到实验目的,A正确;B、在酸性条件下,NO3-具有氧化性,能把Fe2+氧化生成铁离子,铁离子与KSCN溶液发生显色反应,溶液显红色,不能达到实验目的,B不正确;C、下层液体呈紫色,说明反应中有碘生成,即溴与碘化钾发生了置换反应生成了碘和溴化钾,这说明溴的氧化性强于碘的氧化性,C正确;D、将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色,说明反应中有氢氧化铁生成。根据沉淀容易向更难溶的方向转化可知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,D正确,答案选B。
本题难度:一般
3、实验题 (18分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:? Fe3+、Br2哪一个的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液? b.CCl4?c.无水酒精? d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入1~2滴溴水,溶液呈黄色,所发生的离子反应方程式为_____________________________________________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_________。
参考答案:(17分,方程式3分,其余每空2分)
(2) ①Br2 ②Fe3+
(3) 方案1:d 溶液呈红色 ?方案2:b CCl4层呈无色
(4) ①2Fe2++Br2===2Fe3++2Br- ?②1.2 mol/L
本题解析:略
本题难度:一般
4、实验题 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40mL 6mol·L-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出、洗涤、小心烘干、称量。将B、C重复上面的实验。
(1)锌镀层完全反应的标志是________________
(2)如何检验铁片已经洗净 ?________________
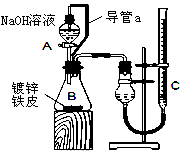
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑。某同学按上图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2.质量为m g的镀锌铁皮放入6mol·L-1 NaOH溶液中。回答下列问题:
(3)装置中导管a的作用是________________________________
(4)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有: ①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。
上述操作的顺序是_______________________ (填序号)。
参考答案:(1)反应速率突然减小 。
(2)取最后一次洗出液,滴加AgNO3溶液,若无白色沉淀,则铁片已洗净。(或用玻璃棒蘸取最后一次洗出液,滴在蓝色石蕊试纸上,若不变红色,则铁片已洗净)。
(3)使分液漏斗和锥形瓶内气压相同,NaOH溶液能顺利滴下。
(4)④①③②④① 。
本题解析:
本题难度:一般
5、选择题 下列各组物质,不用任何试剂即可鉴别开来的是( )
A.NaCl、NaBr、KI三种无色溶液
B.HCl、NaCl、NaNO3、Na2CO3四种溶液
C.NaBr、HCl、KCl三种溶液
D.淀粉、淀粉碘化钾、碘化钾、溴水四种溶液
参考答案:A.三种无色溶液相互滴加都不反应,没有明显的现象,不能鉴别,故A错误;
B.通过相互滴加可鉴别盐酸和Na2CO3,但无法鉴别NaCl和NaNO3,故B错误;
C.NaBr、HCl、KCl三种溶液滴加都不反应,没有明显的现象,不能鉴别,故C错误;
D.溴水呈黄色,可鉴别出,然后用溴水滴加到其它溶液中,淀粉物现象,淀粉碘化钾变蓝,碘化钾溶液变为紫红色,现象各不相同,可鉴别,故D正确.
故选D.
本题解析:
本题难度:一般
|