微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:
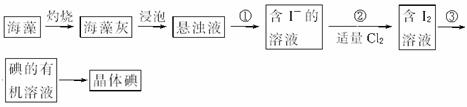
(1)在虚线框内画出实验操作①的仪器装置示意图(见题后说明)。实验操作③的名称是___________,所用主要仪器名称为___________。
(2)提取碘的过程中,可供选择的有机试剂是___________ (填序号)。
A.酒精(沸点78℃)? B.四氯化碳(沸点77℃)
C.甘油(沸点290℃)? D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量Icl,为消除此杂质,使碘全部游离出来,应加入 适量___________ (填序号)溶液,反应的离子方程式为______________________。
适量___________ (填序号)溶液,反应的离子方程式为______________________。
A.KIO3?B.HClO? C.KI?D.Br2
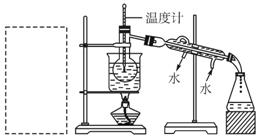
(4)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如上图所示)。请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充)。
①___________,②___________,③___________,
④___________,⑤___________,⑥___________。
(5)实验中使用水浴的原因是______________________,最后晶体碘聚集在___________ (填仪器名称)中。
说明:实验装置中仪器用下面方法表示。铁架台、连接胶管等不必画出,如需加热,在仪器下方用“△”表示。下列图示均为玻璃仪器,应标清液面或固体可视界面。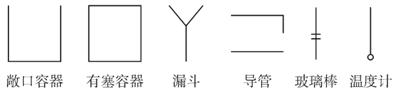
2、实验题 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40mL
6mol·L-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量。将B、C重复上面的实验。
(1)锌镀层完全反应的标志是_____________________。
(2)如何检验铁片已经洗净___________________________________。
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑。某同学按下图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为Scm2、质量为mg的镀锌铁皮放入
6mol·L-1NaOH溶液中。回答下列问题

(3)装置中导管a的作用是_____________________。
(4)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②待B中不再有气体产生并恢复至室温;
③由A向B中滴加足量NaOH溶液;
④上下移动C,使干燥管和C中液面相平。
上述操作的顺序是______________(填序号)。
(5)实验前后碱式滴定管中液面读数分别为V1mL、V2mL(已知Zn的密度为7.14g/cm3,实验条件的气体摩尔体积为VmL/mol。则镀锌铁皮的镀层厚度为_______cm。(写出数学表达式)
3、实验题 请你协助化学兴趣小组的同学完成如下实验,并回答相关问题。实验目的:比较等体积0.5 mol·L-1硫酸、1 mol·L-1盐酸、1 mol·L-1醋酸分别与金属反应生成氢气的速率和体积。
(1)实验原理:(用离子方程式表示)________________。
(2)实验用品:仪器(略)、药品(除给定的三种酸溶液外,在Na、Mg、Fe三种金属中选择最合适的一种,并说明理由)。选择的金属是__________,不选其他两种金属的理由是__________________。
实验步骤:甲同学设计的实验装置:?
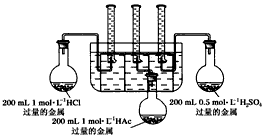
乙同学认为该装置不能控制三个反应在同一时间发生,并作了相应的改进。
(3)你认为乙同学改进的措施是__________________。
(4)按改进后的装置进行实验,观察现象并得出相关结论。实验现象及结论:________________________________________________________________________。
(5)反应开始时的速率:v(H2SO4)__________v(HCl)__________v(HAc)(用“=”“<”或“>”填空,下同),反应进行一段时间后的速率:v(H2SO4)<(HCl)__________v(HAc);
(6)最终得到的氢气体积:V(H2/H2SO4)__________V(H2/HCl)__________V(H2/HAc)。问题讨论:
(7)量筒的规格由__________________决定。
(8)对结论“(6)”“(7)”中盐酸和醋酸的异同,你的解释是__________________。
(9)根据现有知识,上述实验中硫酸和盐酸分别与金属反应的速率应始终都相等,但反应一段时间后有v(H2SO4)<v(HCl)。对此现象,你猜想可能的原因是__________________。大学无机化学对此问题将有科学的解释。
4、计算题 实验欲配制6.00 mol/L的H2SO4溶液.现有三种不同浓度的硫酸:①240 mL 1.00 mol/L的硫酸;②150 mL 25.0%的硫酸(ρ=1.18 g/mL);③足量的18.00 mol/L的浓H2SO4.现有三种规格容量瓶:250 mL、500 mL、1000 mL.配制要求:①、②两种硫酸全部用完,不足部分由③补充.试回答:
(1)选用容量瓶的规格是?。
(2)需要18.0 mol·L-1 H2SO4(aq)的体积是?。
5、填空题 (1)有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)现将溶液两两混合,记录现象如下:
A+B→白色沉淀B+D→白色沉淀C+D→蓝色沉淀
写出上述反应对应的离子方程式:
A+B→白色沉淀:______;
B+D→白色沉淀:______;
C+D→蓝色沉淀:______.
(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性,写出发生反应的离子方程式:______.