微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素原子的核外p电子总数比s电子总数少1
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期
|
C原子核外所有p轨道全满或半满
|
D元素的主族序数与周期数的差为4
|
E是前四周期中电负性最小的元素
|
F在周期表的第七列
|
(1)A基态原子中能量最高的电子,其电子云在空间有?个方向,原子轨道呈?形。
(2)某同学根据上述信息,所画的B电子排布图如图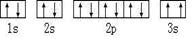 ,违背了?原理。
,违背了?原理。
(3)F位于?族?区,其基态原子有?种运动状态。
(4)CD3 中心原子的杂化方式为?,用价层电子对互斥理论推测其分子空间构型为?,检验E元素的方法是?。
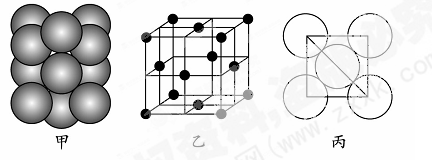
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为?,该单质晶体中原子的堆积方式为四种基本堆积方式中的?。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
参考答案:(1)3;纺锤形或哑铃形?(2)泡利不相容?(3)第三周期第ⅦB;d;25
(4)sp3;三角锥形;焰色反应?(5)12;铜型或面心立方堆积;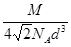
本题解析:A、B、C、D、E为短周期主族元素,原子序数依次增大,A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,即A为N;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C原子核外所有p轨道全满或半满,结合原子序数可知,价电子为3s23p3符合题意,即C为P;D元素的主族序数与周期数的差为4,原子序数大于P,则D为第三周期第ⅦA族元素,即D为Cl;E是前四周期中电负性最小的元素,则E为K;F在周期表的第七列,则F为Mn,则
(1)A为N,能量最高的电子为2p电子,其电子云在空间有3个方向,p轨道为纺锤形;
(2)由泡利原理可知,电子在同一轨道内的自旋方向应相反,B基态原子的核外电子排布图中3s上的两个电子自旋方向相同,则违反了泡利原理;
(3)F为Mn,在第四周期第ⅦB,最后填充的为d电子,在d区,核外电子数为25,有25种运动状态不同的电子;
(4)PCl3中P原子孤电子对数为1,成键数为3,则为sp3杂化,空间构型为三角锥形,F为K,检验K元素应利用焰色反应;
(5)由晶胞结构可知,以顶点原子研究,与之最近的原子处于面心上,每个顶点原子为12个面共用,故晶胞中该原子的配位数为12,该单质晶体中原子的堆积方式为面心立方堆积;由晶胞结构可知,晶胞中原子的数目为8×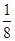 +6×
+6×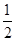 =4,该晶胞中原子的质量=4×
=4,该晶胞中原子的质量=4×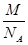 g,由信息可知晶胞图可知为面心立方,原子半径为dcm,由图丙可知,晶胞的棱长="4d" cm×
g,由信息可知晶胞图可知为面心立方,原子半径为dcm,由图丙可知,晶胞的棱长="4d" cm×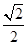 =2
=2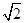 d cm,故晶胞的体积=(2
d cm,故晶胞的体积=(2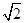 d cm)3=16
d cm)3=16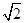 d3 cm3,所以其密度=
d3 cm3,所以其密度=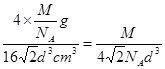 ?g/cm3。
?g/cm3。
本题难度:一般
2、选择题 在预防甲型H1N1流感疫情时,防疫部门使用了含氯类消毒剂,其中的氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4~5倍,下列有关氯胺(NH2Cl)的说法一定不正确的是( )
A.氯胺水解产物为NH2OH(羟氨)和HCl
B.氯胺的消毒原理与漂白粉相似
C.氯胺中氯的化合价为+1
D.氯胺的电子式为
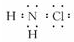
参考答案:A
本题解析:
本题难度:一般
3、选择题 根据等电子原理,下列分子或离子与SO42-有相似结构的是( )
A.PCl5
B.CCl4
C.NF3
D.NO3-
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列分子中,既含有σ键,又含有π键的是
[? ]
A.CH4
B.HCl
C.CH2=CH2
D.F2
参考答案:C
本题解析:
本题难度:简单
5、填空题 下表中的数据是破坏1?mol物质中的化学键所消耗的能量(kJ):
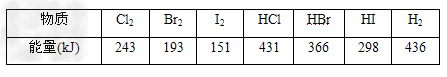
根据上述数据问题。
(1)下列物质本身具有的能量最低的是?_____(填序号)
A.H2?B.Cl2?C.Br2? D.I2
化合物HCl、HBr、HI中______受热时最稳定。
(2)1molH2在2mol?Cl2中燃烧,放出热量________?kJ?。一定条件下,1mol?H2分别与足量Cl2、Br2、I2反应,放出热量由多到少的顺序是________?(填序号)
A?Cl2<Br2<I2?B?Cl2>Br2>I2?
(3)下列有关化学键及键参数的说法中正确的是__________(填序号)
①?原子或分子间的相互作用叫化学键 ?
②?氯分子中两个氯原子间的距离是键长
③?键长的大小与成键原子的半径和成键数目有关
④?键角是描述分子立体结构的重要参数
(4)下列事实不能用键能的大小来解释的是___________(填序号)
A.乙炔比氮气均含三键但是前者比后者容易发生加成反应
B.N2、O2、F2跟氢气的反应能力依次增强
C.硝酸是挥发性酸,而硫酸、磷酸是难不挥发性酸
(5)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
①写出(CN)2与苛性钠溶液反应的离子方程式______________________;
②已知氰分子中键与键之间的夹角为180.,并有对称性,?则结构式为_______?
③氰分子中碳原子为_______杂化;一个氰分子中包含_______个σ键,____个键。
参考答案:(1)A?;HCl?
(2) 183? ;B?
(3) ③④?
(4)C?
(5)?① (CN)2+2OH-══CN-+CNO-+H2O?
② N≡C-C≡N?
③ sp ;3 ;4
本题解析:
本题难度:一般